자외선 조사와 은나노입자 조합을 통한 바이러스 저감 효과에 관한 연구
Abstract
The purpose of this study is to evaluate the antiviral capacity of the combinations Ultraviolet –A (320 –400 nm) or –B (280 –320 nm) (UV –A or –B) and silver nanoparticles (AgNPs).
Combined antiviral effects of ultraviolet-A or –B and AgNPs were tested by plaque assay. Various combinations of UV-A or -B and AgNPs were exposed to tested viruses. Murine norovirus (MNV) and mouse hepatitis virus (MHV) were used as surrogates of human norovirus, known as a causing of viral gastroenteritis in humans and coronavirus, known as a cause of respiratory diseases in humans, respectively.
AgNPs size, concentration and UV kind influenced antiviral capacity. MNV were more susceptive to AgNPs than MHV (p<0.05) while MHV were more susceptive to UV-B (p<0.05). Specially, the combinations of UV-B and 10 nm size (1 ppm or 10 ppm) AgNPs were more effective than UV-B treatment only (p<0.05).
These results suggest that combined antiviral effects of UV-B and AgNPs could be applied in disinfection processes for pathogenic viruses under various environmental conditions.
Keywords:
Silver nanoparticle, ultraviolet, antiviral, murine norovirus, mouse hepatitis virusIntroduction
자외선은 빛의 파장 (wavelength)에 따라 자외선-A (UV-A) (320-400 nm), - B (B; UV-B) (280-320 nm)와 –C (UV-C) (100-280 nm)로 구분할 수 있다 [1]. 자외선 (Ultraviolet, UV)에 의한 미생물 저감 효과는 널리 알려져 있으며, 특히 바이러스 저감 방법으로써 자외선은 사용이 쉽고 경제적이라는 장점을 가지고 있다[2]. 자외선-C는 각종 세균 및 곰팡이뿐만 아니라 poxvirus, hepatitis virus 등에 대한 병원성 바이러스 저감 효과가 뛰어난 것으로 알려져 있다 [3, 4]. 하지만 자외선-C는 투과율이 낮아 오존층 등의 장벽을 통과할 수 없고 [5], 장시간 노출될 경우 피부암 등의 각종 건강 문제를 야기할 수 있다 [6, 7]. 최근에는 바이러스 저감방안으로 자외선-B의 활용에 대한 연구가 지속적으로 수행되고 있다 [5, 8]. 그러나 자외선의 저감 능력은 그 투과가능성에 따라 크게 좌우되기 때문에, 공기 및 수상의 먼지 및 부유물질 등의 농도에 따라 그 효율이 크게 영향을 받을 수 있다 [9]. 이러한 자외선의 한계로 인하여, 최근에는 자외선의 미생물 저감을 방해하지 않으면서도 저감 효율을 높이는 물질들을 복합 사용하는 방안에 대한 연구들이 제시되고 있다.
은 (Silver)의 항균성 효과는 과거로부터 익히 알려져 있다 [10]. 최근 기술이 발전함에 따라, 넓은 표면적과 독특한 물리적, 화학적 특징을 가진 은나노입자 (silver nanoparticle, AgNPs)의 미생물 저감능력이 주목 받고 있다. 은나노입자의 주된 바이러스 저감 기전으로는 은나노입자에서 발생한 활성산소 또는 은나노입자 자체가 흡착 등으로 미생물의 유전자 및 단백질 등의 생체물질에 직접 영향을 주어 불활성화시키는 것으로 알려져 있으며, 은나노입자의 크기가 작을수록 그 표면적이 넓어져 크기가 큰 은나노입자 보다 상대적으로 바이러스 저감 능력이 뛰어나다고 알려져 있다 [11]. 이러한 은나노 입자의 항균성은 자외선의 단점을 보완하고 항균성에 대한 동반 상승효과를 가져올 수 있다.
본 연구에서는 자외선과 은나노입자의 바이러스 저감 효과를 정량적으로 평가하는 것이 목적이다. 자외선 (UV-A, UV-B)와 입자 크기가 다른 은나노입자(10, 40, 60 및 100 nm)를 이용하여 주요 병원성 바이러스의 저감을 정량적으로 결정하였다. 주된 대용 바이러스(surrogates)로써 쥐 노로바이러스 (Murine Norovirus: MNV) [12]와 마우스 간염 바이러스 (Mouse Hepatitis Virus; MHV) [13]를 사용하여 그 저감 결과를 확인 하였는데, MNV는 전세계적으로 장염을 일으키는 주요 미생물로 알려져 있는 사람 노로바이러스 (human norovirus; HuNoV)의 대용 바이러스로 사용 하였고 [14], MHV는 중증 급성 호흡기 증후군(severe acute respiratory syndrome: SARS)의 사례에서 보듯 그 변종이 발생했을 경우 빠른 전파와 높은 사망률을 보이는 특징이 있는 코로나바이러스 (coronavirus)의 대용 바이러스로 사용 하였다 [15]. 마지막으로 본 연구의 실험 결과를 주요 저감 모델인 Chick의 모델(chick’s model) 등에 적용하여 정량적으로 비교 평가를 하였다 [5].
Methods
1. 대상 바이러스
MNV의 숙주세포로 RAW264.7 세포를 사용하였다. RAW264.7의 배양용 배지로 Dulbecco's Modified Eagle Medium (DMEM) (Gibco, USA)에 10% fetal bovine serum (FBS), 10 mM HEPES (Gibco, USA), 10 mM Sodium bicarbonate (Gibco, USA), 10 mM nonessential amino acids (Gibco, USA)와 50 μg/μl gentamicin reagent (Gibco, USA)을 혼합하여 사용하였으며, 멸균 플라스크에 세포를 접종하여 37℃, 5% CO2 배양기에서 배양하였다. 실험에 사용할 바이러스를 얻기 위하여, 완전히 자라 단층을 형성한 RAW264.7 세포에 MNV를 접종시켜 3-4일간 독립적인 37℃, 5% CO2 배양기에서 배양하였다. 감염된 세포는 바이러스의 세포 탈출을 위해 얼림과 녹임을 세 번 반복하였다. 바이러스 정제를 위해 클로로포름(chloroform, Amresco, USA)을 동량 (1:1)을 첨가한 후 4℃에서 원심 분리하였으며 (5,000 g × 20 min), 한외여과기 (Amicon Ultra-15 tube, Millipore, USA)로 바이러스를 포함한 상층액을 농축하여 바이러스 stock을 확보하였다. 확보된 바이러스는 사용하기 전까지 -80℃에서 보관하였다 [5].
MNV 정량에는 배양법 (plaque assay)을 사용하였다. 이를 위해 배양한 RAW264.7 세포를 수확하여 멸균된 6-well plate에 5 × 106 cells/well로 재차 분주한 후, 6시간 동안 37℃, 5% CO2 배양기에서 배양하였다. 세포를 포함한 6-well plate의 well에, 0.5 ml DMEM과 FBS가 첨가되지 않은 DMEM (serum free DMEM)을 사용하여 계대 희석한 MNV를 0.5 ml씩 접종하였다. MNV를 접종한 plate는 60분간 배양기에서 배양하였으며, 15분 간격으로 흔들어 바이러스의 숙주세포 감염을 촉진하였다. 접종배지와 바이러스를 제거한 후 SeaPlaque agarose (Lonza, Basel, Switzerland) 와 2× MEM을 혼합하여 만든 유지용 배지를 3 ml 투입하여 10분간 실온에 두어 완벽하게 굳혔다. 이후 37℃, 5% CO2 배양기에서 72-96 시간 배양하여 나타난 plaque를 계수하였다 [16].
MHV의 숙주세포로 L2 세포를 사용하였다. L2의 배양용 배지로 Dulbecco's Modified Eagle Medium (DMEM) (Gibco, USA)에 10% FBS, 10 mM HEPES (Gibco, USA), 10 mM Sodium bicarbonate (Gibco, USA), 10 mM nonessential amino acids (Gibco, USA)와 50 μg/μl gentamicin reagent (Gibco, USA)을 혼합하여 사용하였으며, 멸균 플라스크에 세포를 접종하여 37℃, 5% CO2 배양기에서 배양하였다. 실험에 사용할 바이러스를 얻기 위하여, 완전히 자라 단층을 형성한 L2 세포에 MHV를 접종시켜 1-2일간 독립적인 37℃, 5% CO2 배양기에서 배양하였다. 감염된 세포는 바이러스의 세포탈출을 위해 얼림과 녹임을 세 번 반복하였다. 바이러스 4℃에서 원심 분리하였으며 (5,000 g × 20 min), 한외여과기 (Amicon Ultra-15 tube, Millipore, USA)로 바이러스를 포함한 상층액을 농축하여 바이러스 stock을 확보하였다. 확보된 바이러스는 사용하기 전까지 -80℃에서 보관하였다 [17].
MHV 정량에는 배양법 (plaque assay)을 사용하였다. 이를 위해 배양한 L2 세포를 수확하여 멸균된 6-well plate에 5 × 106 cells/well로 재차 분주한 후, 6시간 동안 37℃, 5% CO2 배양기에서 배양하였다. 세포를 포함한 6-well plate의 well에, 0.5 ml DMEM과 FBS가 첨가되지 않은 DMEM (serum free DMEM)을 사용하여 개대 희석한 MHV를 0.5 ml씩 접종하였다. MHV를 접종한 plate는 60분간 배양기에서 배양하였으며, 15분 간격으로 흔들어 바이러스의 숙주세포 감염을 촉진하였다. 접종배지와 바이러스를 제거한 후 SeaPlaque agarose (Lonza, Basel, Switzerland)와 2× MEM을 혼합하여 만든 유지용 배지를 3 ml 투입하여 10분간 실온에 두어 완벽하게 굳혔다. 이후 37℃, 5% CO2 배양기에서 24-48 시간 배양하여 나타난 plaque를 계수하였다 [17, 18].
2. 자외선과 은나노입자 조합의 바이러스 저감 실험
자외선의 바이러스 저감 효과를 확인하기 위하여 자체 제작한 자외선 조사 장치를 이용하였다. 자외선 조사 장치는 검정색 사각형 상자 모양의 외관으로 크게 세 부분으로 구성되어 있다. 이를 간략히 살펴보면 자외선 램프 조사기 및 자외선이 수직으로 조사되도록 하는 실린더형 튜브, 검체를 비치하는 트레이로 구성되어 있다. 자외선 램프는 자외선-A 램프 (10W, Sankyo Denki Go., Japan) 와 자외선-B 램프 (8W, Sankyo Denki Go., Japan) 를 사용하였고, 자외선 조사량 측정 전 예열을 위하여 30분간 자외선 램프를 켜 놓았다. 자외선 조사량은 검체 트레이와 동등한 높이 및 위치에서 VLX3W radiometer (CX-365 and CX-312, Cole-Parmer Instrument. Co., IL, USA)를 활용하여 3회 반복 측정하였으며, 평균 자외선 조사량은 Beer-Lambert 법칙을 적용하여 계산하였다[19].
바이러스에 따른 자외선 조사량은 Table 1과 같다. 자외선 조사장치의 자외선-A 램프의 자외선 발생량은 0.078 mW/cm2 였고, 누적 자외선 조사랑은 140 mJ/cm2 (30분), 280 mJ/cm2 (60분), 560 mJ/cm2 (120분), 840 mJ/cm2 (180분) 이었다. 자외선-B의 자외선 발생량은 자외선-B 램프 한 개를 사용할 경우 (0.135 mW/cm2) 및 2개를 사용할 경우 (0.285 mW/cm2)에 따라 차이를 보였다. 자외선-B 램프 한 개의 누적 조사량은 80 mJ/cm2 (10분), 160 mJ/cm2 (20분), 240 mJ/cm2 (30분)이었으며, 자외선-B램프 두 개의 누적 조사량은 170 mJ/cm2 (10분), 340 mJ/cm2 (20분), 510 mJ/cm2 (30분)이었다 (Table 1).
먼저 1 × 106 PFU/ml (plaque forming unit/ml) 의 MNV 또는 1 × 107 PFU/ml 의 MHV가 포함된 10 ml 바이러스 부유액을 확보한 후, 60 mm 규격의 페트리디쉬에 넣어 자외선 조사장치의 시료 트레이에 비치하였다. 이후 예비실험을 근간으로 확보한 자외선-A 및 자외선-B의 조사 시간에 의거하여 정확히 조사한 다음, 주어진 시간에 맞추어 시료를 채취하였다. 자외선-A는 총 180분에 걸쳐 조사하였으며, 0, 30, 60, 120, 180분에 시료를 채취하였다 [5]. 자외선-B는 그 강도를 2가지 (0.135 mW/cm2, 0.285 mW/cm2)로 설정해 바이러스 저감 효과를 살펴보았다. 자외선-B의 조사 시간은 두 모델바이러스간 차이를 두었다. 이에 MNV는 총 30분에 걸쳐 조사하였고 0, 10, 20, 30분에 시료를 채취하였으며, MHV는 총 10분에 걸쳐 조사 하였으며 0, 1, 5, 10분에 시료를 채취하였다. 채취한 시료 상에 존재하는 생존 바이러스들은 상기의 배양법에 따라 정량적으로 분석하였다[16, 17].
크기가 다른 네 가지 은나노입자 (10, 40, 60 and 100 nm) (Sigma-Aldrich, St Louis, MO, USA)와 MNV, MHV를 반응시켜 은나노입자의 바이러스 저감 효과를 측정하였다. 이를 위해 먼저 2 ppm 농도의 은나노입자 용액과 2 × 106 PFU/ml MNV 또는 MHV 부유액 0.5 ml를 반응시켜 최종 은나노입자 농도를 1 ppm으로 맞추었다. 이후 항온교반기 (SI-600R, Lab Companion., USA) 상에서 실온 (25℃) 및 180 rpm의 교반속도로 반응시켰으며, 180 분간의 반응 이후 배양법을 활용하여 바이러스의 저감정도를 측정하였다 [5].
또한 은나노입자의 농도에 따른 모델 바이러스의 저감 변화를 확인하기 위하여, 10 nm 및 100 nm 크기의 은나노입자를 각기 0.1 ppm, 1 ppm 및 10 ppm (10 nm) 과 0.1 ppm및 1 ppm(100 nm)로 농도로 구비하여 1 × 106 PFU/ml MNV 또는 MHV과 혼합 반응시켰다 (25℃, 180 rpm, 180 분). 시료 상에 생존한 바이러스는 배양법을 활용하여 측정하였다.
자외선-A 및 자외선-B와 두 종류의 농도 (0.1 ppm, 1 ppm) 10 nm 및 100 nm 은나노입자를 선정하여, 서로 조합한 후의 바이러스 저감 능력을 확인하였다. 먼저 10 nm와 100 nm 은나노입자를 DMEM 배지로 희석하여 0.2 ppm 또는 2 ppm 용액 (5 ml)을 만든 후, 여기에 일정양의 바이러스 (MNV: 2 × 106 PFU/ml, MHV:2 × 107 PFU/ml) 부유액 (5 ml)을 넣어 잘 교반한 후 자외선을 조사하였다. 자외선-A는 1개의 램프를 사용하여 조사하였으며, 총 180 분까지 5 회의 시료 채취 시간 (0, 30, 60, 120 및 180 분)을 두어 시료를 확보한 후 배양법을 통해 바이러스를 정량적으로 분석하였다. 자외선-B의 경우, 조사 강도의 차이를 두기 위하여 램프의 개수를 1 또는 2개로 변경 설정하여 실험을 수행하였다. 전술한 바와 동일하게, 자외선-B와 은나노입자 조합 반응의 시료 체취시간은 모델 바이러스의 종류에 따라 달리하였다. 이에 MNV는 0, 10, 20 및 30분 조사 후 시료를 채취하였고, MHV는 0, 1, 5 및 10 분 조사 후 시료를 채취하였다. 이후 배양법을 통해 바이러스를 정량적으로 분석하였다.
3. 바이러스 저감 결과에 대한 Chick’s 모델 적용
자외선 조사량 (dose)에 따른 모델 바이러스 저감 결과에 Chick’s model을 적용하였다. 이때 Chick’s model 계산식은 다음과 같다 (5).
Nt: present the number of viral particles at time t
No: virus particles at zero time
k: the slope of inactivation curve
i: the UV light energy intensity
4. 통계분석
모든 통계분석은 Sigma-Plot (version 12.0, Systat Software, Inc., San Jose, CA, USA)으로 수행하였다. 은나노입자의 크기에 따른 바이러스 저감 효과를 비교하기 위하여 Kruskal-Wallis one way ANOVA test 및 사후검정(Tukey)을 실시하였다. 자외선-A, -B단독으로 반응과 자외선-은나노입자 조합 반응의 바이러스 저감 효과의 차이를 비교하기 위해 paired t-test를 사용하였다. 각 분석에서 통계적으로 유의한 차이의 기준은 p < 0.05로 설정하였다.
Results
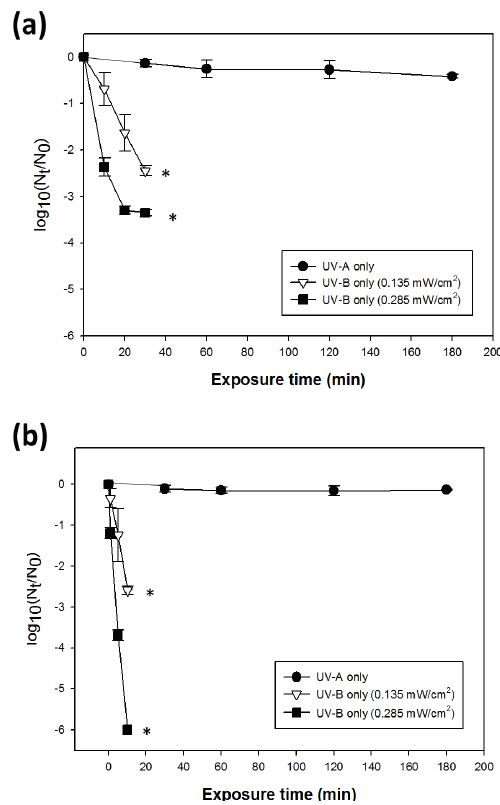
1. 자외선의 바이러스 저감 효과
자외선의 종류에 따른 바이러스 저감 효과는 자외선-A의 경우 180분 조사 후 대조군 대비 0.41-log10의 MNV 및 0.14-log10의 MHV 저감 효과를 나타냈다 (Figure 1). 또한 자외선-B를 0.135 mW/cm2의 강도로 조사한 경우, MNV는 30분 내 2.45-log10의 저감을 나타내었으며, MHV의 경우 10분 내 2.59-log10의 저감 효과가 나타났다 (Figure 1). 자외선-B를 0.285 mW/cm2의 강도로 조사하였을 때 MNV는 30분 조사 후 3.35-log10의 높은 저감 효과를 보였으며, MHV의 경우 10분 내 >6-log10의 뛰어난 저감 효과를 보였다. 두 모델 바이러스에 대한 자외선-B의 저감 효과는 자외선-A보다 유의하게 높았으며 (p < 0.05), 높은 강도의 자외선-B를 조사할 경우 더욱 강력한 바이러스 저감 효과가 나타나는 것을 확인하였다 (p< 0.05)(Figure 1).
2. 은나노입자의 바이러스 저감 효과
크기가 다른 네 가지 은나노입자 (10, 40, 60, 100nm)를 다른 농도 (0.1, 1, 10 ppm)로 두 가지 대상 바이러스와 180분간 반응시켜 얻은 저감 결과는 전반적으로 MNV가 MHV에 비해 은나노입자와의 반응에 취약한 것으로 나타났다. 아울러 여러 농도의 10 nm 및 100 nm 은나노입자를 모델 바이러스들과 반응시킨 결과는 Figure 2과 같다. 결과적으로 10 nm 은나노입자가 더 바이러스들을 잘 저감하는 것으로 나타났으며, 특히 가장 높은 농도인 10 ppm의 10 nm 은나노입자는 180분 간의 반응 이후 통계학적으로 유의하게 MNV를 저감함을 알 수 있었다 (p < 0.05) (Figure 2).
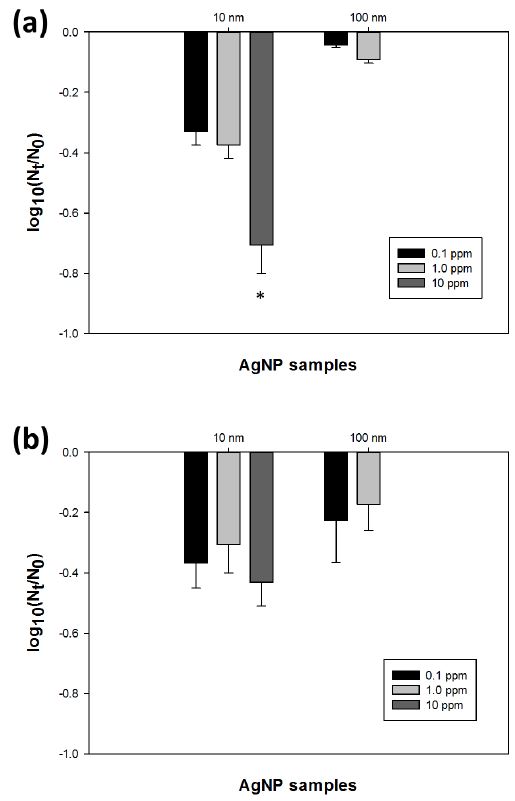
Inactivation of tested AgNPs (10 nm particles with 10 ppm, 1 ppm and 0.1 ppm; 100 nm with 1 ppm and 0.1 ppm).(a) MNV; (b) MHV. Asterisks indicate significantly different values (p < 0.05 by Kruskal-Wallis one-way ANOVA with Tukey test). Nt: present the number of viral particles at time t, No: virus particles at zero time.
3. 자외선과 은나노입자의 바이러스 저감 효과
자외선-A 및 은나노입자를 조합하여 모델 바이러스들을 저감한 결과 모든 실험 설계 상에서 MNV는 0.14-log10에서 0.44-log10 사이의 저감을 보였으며, MHV는 0.11-log10에서 0.36-log10 상의 저감을 보였다. 특히 1 ppm의 10 nm 은나노입자를 조합 반응시켰을 때의 바이러스 저감 (MNV: 0.44-log10, MHV: 0.36-log10)이 가장 높게 나타났지만, 통계적으로는 유의하지는 않았다.
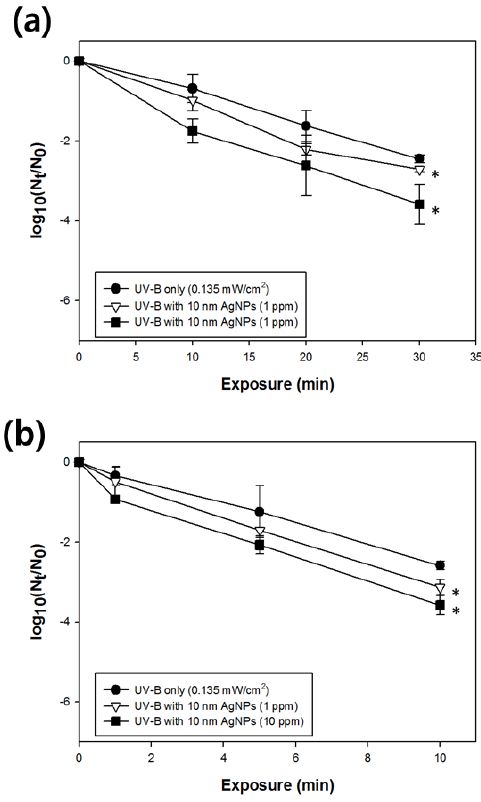
대략 0.285 mW/cm2 의 자외선-B 조사와 은나노입자의 조합을 바탕으로 두 모델 바이러스의 저감 효과를 확인한 결과 1 ppm의 10 nm 은나노입자를 조합 반응시켰을 때의 MNV 저감효과 (4.35-log10)는 대조군과 비교하여 유의하게 높게 나타나는 것을 확인할 수 있었다(Figure 3) (p < 0.05). MHV 역시 1 ppm의 10 nm 은나노입자를 조합 반응시켰을 때 단 1분의 반응시간으로도 2.14-log10 의 저감 효과를 보이는 것을 확인하였으며, 이는 자외선-B 단독반응에 비해 유의하게 높은 수치이다 (p < 0.05).
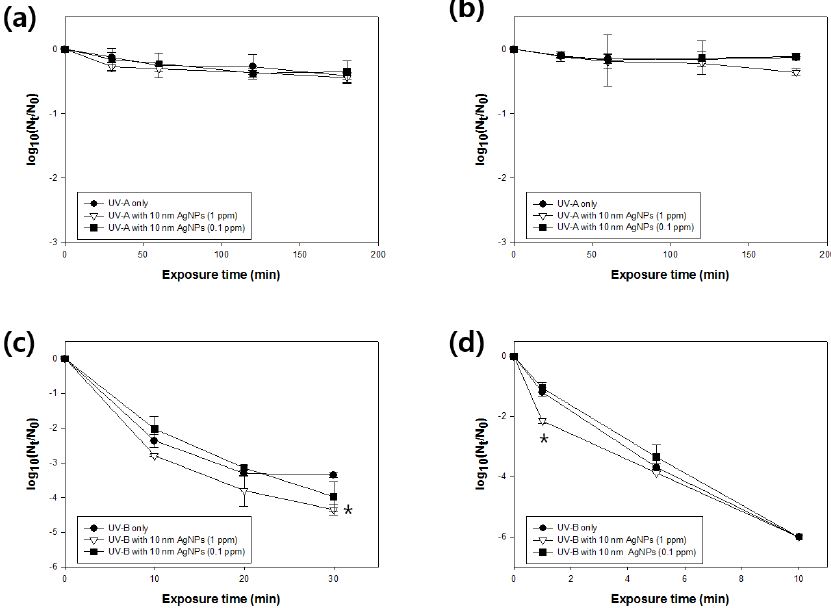
Inactivation of tested UV-A (0.078 mW/cm2), UV-B (0.285 mW/cm2) with and without 10 nm AgNPs (1 ppm or 0.1 ppm).(a) UV-A and AgNPs with MNV; (b) UV-A and AgNPs with MHV; (c) UV-B and AgNPs with MNV; (d) UVB and AgNPs with MHV. Asterisks indicate significantly different values. (p < 0.05 by paired t-test). Nt: present the number of viral particles at time t, No: virus particles at zero time.
또한 0.135 mW/cm2 로 조사 강도를 낮추어 은나노입자들과 조합한 결과는 Figure 4와 같다. 역시, 1 ppm의 10 nm 은나노입자를 조합 반응시킬 경우 MNV는 30분 내 2.71-log10, MHV는 10분 내 3.12-log10의 저감도를 보여 자외선-B 단독으로 저감한 것 보다 유의하게 높은 것을 확인할 수 있었다 (p < 0.05) (Figure 4). 또한 10 ppm의 10 nm 은나노입자를 조합 반응시킬 경우 보다 높은 바이러스 저감 능력을 보이는 것을 확인하였다 (Figure 4). 이에 MNV는 30분 내 3.58-log10, MHV는 10분 내 3.58-log10 의 저감도를 보여 자외선-B 단독으로 저감한 것 보다 유의하게 높은 것을 확인할 수 있었다.
4. 바이러스 저감 모델 분석
두 바이러스의 저감 결과에 대해 Chick’s model을 적용한 결과는 Table 2와 같다. 자외선-B를 활용한 바이러스 저감의 경우 단독 및 은나노입자의 조합 결과 모두 높은 R2 값을 보였다 (0.8226 - 0.9090) (Table 2). 반면에, 자외선-A를 활용한 바이러스 저감 결과의 경우, 대부분 R2 값이 0.5 미만으로 낮았다 (Table 2).
Discussion
자외선은 일반적으로 태양광에 포함되어 있으며, 특히 자외선-B의 경우 지상까지 보다 잘 도달할 수 있는 장점과 충분한 미생물 저감 효과로 인하여 꾸준한 관심을 받고 있다 [20, 21]. 특히 자외선-B는 Pseudomonas aeruginosa, E. coli 등에 대한 살균 효과 및 MNV, MS3, T4, T7, human immunodeficiency virus (HIV) 등의 바이러스에 대한 저감 효과가 있다고 보고되고 있다 [22, 23]. 본 연구에서 사용한 자외선 조사장치는 사용자의 자외선 노출로부터 안전하고 효과적인 바이러스 저감이 가능하다는 점으로 미루어볼 때 향후 그 활용가능성이 높다고 할 수 있다.
은나노입자 역시 병원성 미생물 및 곰팡이 등에 대한 높은 저감능력을 가지고 있으며, HIV, hepatitis B virus, herpes simplex virus, respiratory syncytial virus, monkey pox virus 등의 다양한 바이러스 들에 대해 높은 저감 효과를 가지고 있는 것으로 알려져 있다 [24, 25]. 본 연구 결과, 같은 조건 하에서도 MNV가 MHV에 비해 높은 저감을 보이는 것을 확인할 수 있었다 (Figure 2). MNV는 외피를 보유하지 않은 RNA 바이러스로 비교적 그 크기가 작은 반면, MHV는 외피를 보유한 바이러스로 크기가 비교적 크며 더욱 긴 유전체를 가지고 있다[26, 27]. 이러한 은나노입자에 따른 모델 바이러스들의 저감 효과 차이는 곧 각 바이러스의 내재적인 특성인 외피 유무, 크기 및 핵산 등의 차이와 [28] 은나노입자의 크기 및 농도 등이 바이러스 저감 효과에 있어 중요한 요인으로 작용할 수 있다는 것으로 [10], 실제 자외선과의 조합 활용에 있어서 충분한 고려 사항들이 될 수 있다.
아울러, 자외선-B와 1 ppm의 10 nm 은나노입자를 조합 반응 시켰을 때, 자외선-B의 단독조사와 비교하여 모델 바이러스들의 저감 효과가 유의하게 상승하는 것을 확인할 수 있었다(Figure 3). 또한 자외선-B와 10 ppm의 은나노입자를 조합하였을 경우 MNV와 MHV 모두에서 가장 효과적인 바이러스 저감 능력을 나타냈다. 이는 10 ppm 내외의 은나노입자 농도는 자외선-B의 미생물 저감에 큰 영향을 미치지는 것을 의미한다. 아울러, 자외선-B 및 은나노입자는 각기 차별적인 바이러스 저감 기전을 가지고 있다. 자외선은 바이러스의 캡시드 내 핵산들의 피리미딘 이중결합을 손상시킬 수 있으며, 은나노입자의 경우 바이러스 표면을 구성하는 생체분자들 상의 인산기 및 황산기 등과 결합하여 불활성화시킬 수 있다 [10, 28]. 이에 곧, 본 실험에서 사용한 두 주요 저감 방법의 조합은 서로 상충되기 보다는 상호 보완적인 저감방법으로써 활용이 가능하다는 것을 의미한다. 특히 자외선-B의 경우 그 투과력이 저감 효율에 있어 중요하기에, 향후 더욱 다양한 농도의 은나노입자를 활용하여 투과력을 억제하지 않는 선의 최적 조합 농도를 제시한다면 더욱 높은 활용성을 가질 수 있을 것이라 사료된다.
자외선-A의 경우 180 분의 조사에도 불구하고 바이러스 저감 효과가 크지 않으며, 은나노입자와의 조합 적용에도 불구하고 0.50-log10 이내의 낮은 저감 효과를 보였다 (Figure 3). 과거 연구에서 확인할 수 있듯이 자외선-B 및 자외선–C에 비해 자외선-A의 바이러스 핵산에 대한 영향은 현저히 떨어지며 [5], 이에 조합에 따른 저감 결과는 대부분 은나노입자 들에 기인한 것으로 여겨진다. 따라서, 본 실험 결과로 미루어볼 때 자외선-A와 은나노입자의 조합은 큰 활용성이 없을 것으로 사료되며, 자외선-A를 바이러스 저감에 적절히 활용하기 위해서는 TiO2 및 coriandrin 등의 광 촉매반응을 통하여 더욱 많은 활성산소를 발생하도록 하는 접근 방법이 더욱 타당할 수 있다 [29, 30].
아울러 본 연구에서는 자외선과 은나노입자 조합을 통한 바이러스 저감 효과를 적절히 예측하기 위하여 잘 알려진 자외선 바이러스 저감 모델로 널리 알려져 있는 Chick’s model을 사용하여 분석하였다 [5, 23, 29]. Chick’s model을 바이러스 저감 결과에 적용한 결과, 자외선-B와 은나노입자의 조합의 경우 자외선 단독 활용과 유사하게 높은 R2값들을 확보할 수 있었으며(Table 2), 이는 본 조합에 의거한 저감을 자외선과 비슷한 선형모델로서 설명하는 것이 가능하다는 것을 의미한다. 즉, 본 연구에 사용된 두가지 모델 바이러스의 바이러스 저감 효과를 확인 함으로써 소화기 질병을 일으키는 노로바이러스와 호흡기 질병을 일으키는 코로나바이러스의 바이러스 저감 효과를 확인하였고 이는 향후 다양한 바이러스의 적용이 기대된다.
Conclusion
자외선-B와 은나노입자를 이용하여 두 종류의 모델 바이러스인 MNV 및 MHV와 반응 시킨 결과 두 모델 바이러스 모두 상당한 저감 효과를 확인 할 수 있었다. 자외선-B의 경우 0.285 mW/cm2의 강도로 조사하였을 때 두 모델 바이러스 모두에 높은 바이러스 저감 효과를 나타내었고, 은나노입자는 10 ppm 농도 10 nm 크기 은나노입자가 바이러스 저감 효과를 나타냈다. 이들 자외선-B의 강도와 은나노입자 농도를 조합 반응 하였을 때 가장 효과적인 바이러스 저감 효과를 나타냈으며 이는 자외선-B와 은나노입자가 상호 보완적인 작용으로 인한 것이라 사료된다. 또한 자외선-B와 은나노입자를 조합반응을 이용한 두 바이러스의 저감 결과를 Chick’s model에 적용한 결과 높은 R2 값을 보여 유해 바이러스들에 대한 저감 방안으로서의 가능성을 확인할 수 있었다. 이에 향후 다양한 환경 조건 및 여러 가지의 모델 바이러스들을 적용한 저감 데이터를 확보함으로써 본 조합을 보다 최적화하는 연구를 수행하는 것이 필요하다.
References
-
Darnell, ME, Subbarao, K, Feinstone, SM, Taylor, DR, Inactivation of the coronavirus that induces severe acute respiratory syndrome, SARS-CoV, Journal of virological methods, (2004), 121(1), p85-91.
[https://doi.org/10.1016/j.jviromet.2004.06.006]

- Jang, I, Kim, J, Using the ultraviolet disinfection water treatment technology, Lighting Electric Installation Engineers, (2005), 19(5), p18-9.
-
Caillet-Fauquet, P, Di Giambattista, M, Draps, ML, Sandras, F, Branckaert, T, De Launoit, Y, et al. , Continuous-flow UVC irradiation: a new, effective, protein activity-preserving system for inactivating bacteria and viruses, including erythrovirus B19, Journal of virological methods, (2004), 118(2), p131-9.
[https://doi.org/10.1016/j.jviromet.2004.02.002]

- Sullivan, P, Conner-Kerr, T, A comparative study of the effects of UVC irradiation on select procaryotic and eucaryotic wound pathogens, Ostomy/wound management, (2000), 46(10), p28-34.
-
Lee, JE, Ko, G, Norovirus and MS2 inactivation kinetics of UV-A and UV-B with and without TiO 2, Water research, (2013), 47(15), p5607-13.
[https://doi.org/10.1016/j.watres.2013.06.035]

-
Brash, DE, Rudolph, JA, Simon, JA, Lin, A, McKenna, GJ, Baden, HP, et al. , A role for sunlight in skin cancer: UV-induced p53 mutations in squamous cell carcinoma, Proceedings of the National Academy of Sciences, (1991), 88(22), p10124-8.
[https://doi.org/10.1073/pnas.88.22.10124]

-
Nolan, TM, DiGirolamo, N, Sachdev, NH, Hampartzoumian, T, Coroneo, MT, Wakefield, D, The role of ultraviolet irradiation and heparinbinding epidermal growth factor-like growth factor in the pathogenesis of pterygium, The American journal of pathology, (2003), 162(2), p567-74.
[https://doi.org/10.1016/s0002-9440(10)63850-3]

-
Giannini, S, Effects of ultraviolet B irradiation on cutaneous leishmaniasis, Parasitology Today, (1992), 8(2), p44-8.
[https://doi.org/10.1016/0169-4758(92)90083-e]

- Johnson, K, Kumar, MA, Ponmurugan, P, Gananamangai, BM, Ultraviolet Radiation and its germicidal effect in drinking water purification, Journal of Phytology, (2010), 2(5).
-
Park, S, Park, HH, Kim, SY, Kim, SJ, Woo, K, Ko, G, Antiviral properties of silver nanoparticles on a magnetic hybrid colloid, Applied and environmental microbiology, (2014), 80(8), p2343-50.
[https://doi.org/10.1128/aem.03427-13]

-
Xu, H, Qu, F, Xu, H, Lai, W, Wang, YA, Aguilar, ZP, et al , Role of reactive oxygen species in the antibacterial mechanism of silver nanoparticles on Escherichia coli O157: H7, Biometals, (2012), 25(1), p45-53.
[https://doi.org/10.1007/s10534-011-9482-x]

- Park, GW, Linden, KG, Sobsey, MD, Inactivation of murine norovirus, feline calicivirus and echovirus 12 as surrogates for human norovirus (NoV) and coliphage (F+) MS2 by ultraviolet light (254 nm) and the effect of cell association on UV inactivation, Letters in applied microbiology, (2011), 52(2), p162-7.
-
Hulkower, RL, Casanova, LM, Rutala, WA, Weber, DJ, Sobsey, MD, Inactivation of surrogate coronaviruses on hard surfaces by health care germicides, American journal of infection control, (2011), 39(5), p401-7.
[https://doi.org/10.1016/j.ajic.2010.08.011]

-
Lee, G, Lee, C, Park, C, Jeong, S, Detection and molecular characterization of enteroviruses in Korean surface water by using integrated cell culture multiplex RT-PCR, Biomedical and environmental sciences : BES, (2008), 21(5), p425-31, Epub 2009/01/13..
[https://doi.org/10.1016/s0895-3988(08)60064-1]

-
Consortium CSME, Molecular evolution of the SARS coronavirus during the course of the SARS epidemic in China, Science, (2004), 303(5664), p1666-9.
[https://doi.org/10.1126/science.1092002]

- Gonzalez-Hernandez, MB, Bragazzi Cunha, J, Wobus, CE, Plaque assay for murine norovirus, Journal of visualized experiments : JoVE, 2012(66), pe4297, Epub 2012/09/07..
- Leibowitz, J, Kaufman, G, Liu, P, Coronaviruses: propagation, quantification, storage, and construction of recombinant mouse hepatitis virus, Current protocols in microbiology, 2011, p15E. 1.1-E. 1.46.
- Sun, A, Camilli, A, Portnoy, D, Isolation of Listeria monocytogenes small-plaque mutants defective for intracellular growth and cell-tocell spread, Infection and immunity, (1990), 58(11), p3770-8.
-
Ko, G, Cromeans, TL, Sobsey, MD, UV inactivation of adenovirus type 41 measured by cell culture mRNA RT-PCR, Water research, (2005), 39(15), p3643-9.
[https://doi.org/10.1016/j.watres.2005.06.013]

-
Lytle, CD, Sagripanti, J-L, Predicted inactivation of viruses of relevance to biodefense by solar radiation, Journal of virology, (2005), 79(22), p14244-52.
[https://doi.org/10.1128/jvi.79.22.14244-14252.2005]

-
Sagripanti, JL, Lytle, CD, Inactivation of influenza virus by solar radiation, Photochemistry and photobiology, (2007), 83(5), p1278-82.
[https://doi.org/10.1111/j.1751-1097.2007.00177.x]

-
Kidambi, SP, Booth, MG, Kokjohn, TA, Miller, RV, recA-dependence of the response of Pseudomonas aeruginosa to UVA and UVB irradiation, Microbiology, (1996), 142(4), p1033-40.
[https://doi.org/10.1099/00221287-142-4-1033]

- Mamane, H, Shemer, H, Linden, KG, Inactivation of E. coli, B. subtilis spores, and MS2, T4, and T7 phage using UV/H 2 O 2 advanced oxidation, Journal of hazardous materials, (2007), 146(3), p479-86.
-
Galdiero, S, Falanga, A, Vitiello, M, Cantisani, M, Marra, V, Galdiero, M, Silver nanoparticles as potential antiviral agents, Molecules, (2011), 16(10), p8894-918.
[https://doi.org/10.3390/molecules16108894]

-
Rai, M, Yadav, A, Gade, A, Silver nanoparticles as a new generation of antimicrobials, Biotechnology advances, (2009), 27(1), p76-83.
[https://doi.org/10.1016/j.biotechadv.2008.09.002]

-
Clarke, IN, Lambden, PR, Organization and expression of calicivirus genes, Journal of Infectious Diseases, (2000), 181(Supplement 2), pS309-S16.
[https://doi.org/10.1086/315575]

-
Marra, MA, Jones, SJ, Astell, CR, Holt, RA, Brooks-Wilson, A, Butterfield, YS, et al. , The genome sequence of the SARS-associated coronavirus, Science, (2003), 300(5624), p1399-404.
[https://doi.org/10.1126/science.1085953]

-
Wigginton, KR, Kohn, T, Virus disinfection mechanisms: the role of virus composition, structure, and function, Current opinion in virology, (2012), 2(1), p84-9.
[https://doi.org/10.1016/j.coviro.2011.11.003]

-
Robertson, JM, Robertson, PK, Lawton, LA, A comparison of the effectiveness of TiO 2 photocatalysis and UVA photolysis for the destruction of three pathogenic microorganisms, Journal of Photochemistry and Photobiology A: Chemistry, (2005), 175(1), p51-6.
[https://doi.org/10.1016/j.jphotochem.2005.04.033]

-
Hudson, J, Graham, E, Harris, L, Ashwood‐Smith, M, The unusual UVAdependent antiviral properties of the furoisocoumarin, coriandrin, Photochemistry and photobiology, (1993), 57(3), p491-6.
[https://doi.org/10.1111/j.1751-1097.1993.tb02324.x]