바이오모니터링에 대한 학문적 고찰
Abstract
Biomonitoring is a useful tool in various activities on environmental health especially for association between chemical exposure and health outcomes. It provides unequivocal evidence of exposure as well as estimates of exposure amounts with some assumptions or utilization of model. Recently, biomonitoring is getting popular and many scientists could obtain biomarker-related data sets easily since high-end instruments for analysis have prevailed so as to detect trace levels of environmental chemicals in biological samples, and various data from large-scale of biomonitoring projects are available to scientists. Interpretation of biomonitoring for health risk assessment requires experienced knowledge and expertise. Levels of biomarker itself cannot describe historic exposure. The results could be confounded due to inappropriate allocation of responsible source. The specimens with detection of a substance might be reflect actual exposure amount or might not be relevant to target organ dose or biologically effective dose. Therefore, meticulous records are needed along with biomonitoring, which are related with information of demographics, life-style or other exposure related factors as well as source or pathways of exposure. Recently, Ministry of Environment released the Korean National Environmental Health Survey (KoNEHS) which was performed 2009 to 2011 and 2012 to 2014 among South Korean. KoNEHS was a large scale survey and precious values in environmental health in Korea such as providing reference values and distribution of internal dose in Korean population. In this review, some academic of advice were suggested for prospective future of the survey, which works as scoping institution and solid information source of status and trends of environmental exposure among general public in Korea.
서론
바이오모니터링(biomonitoring)은 미국 학술위원회(US National Research Council)의 정의에 따르면 환경유해물질의 노출과 건강영향에 대해 노출과 건강영향 및 감수성에 대한 정보를 아우르는 방법론으로서 바이오마커(Biomark ers)를 이용한 사업이나 연구행위를 의미하지만[1], 통상, 노출 바이오마커를 사용하여 소변이나 혈액과 같은 생체지표에서 환경유해물질 원물질 또는 그 대사체를 측정하는 노출 바이오모니터링을 의미하는 경우가 많다. 이는 바이오마커에 대한 이해와 쓰임새에 대한 인식을 반영한 것으로 다시 말해, 노출평가(exposure assess ment)의 영역에 노출 바이오마커의 활용을 의미한 것이다. 다양한 노출평가관련 바이오모니터링에도 특정 인구집단을 대상으로 연구가설에 기반(hypothesis-derived)하여 문제해결을 위한 연구용 바이오모니터링이 있는가 가면, 보다 넓은 인구집단(population-based biomonitor ing)에 대해 서베이(survey)용 바이오모니터링도 있다. 후자의 경우, 우리나라 환경부/국립환경과학원에서 진행하는 ‘국민환경보건기초조사’[2] 와 같은 사업과 미국 질병관리본부(US Centers for Disease Control and Prevention, CDC)가 주관하는 ‘National Health and Nutrition Examination Survey’(NHANES)의 사례에서 보듯이, 전국민을 대상으로 유해물질 노출수준과 노출관련 요인을 파악하는 국가사업으로 수행되는 것으로서 연구에 활용될 수도 있지만 연구가설기반연구와는 조금 다른 성격을 지니고 있다. 바이오모니터링을 통해 생체에서 유해물질을 측정하면 노출이 바로 확인될 수 있다는 생각이 유력한 증거로 인식되는 측면과 함께 정밀측정장비 보급의 보편화로 바이오모니터링 연구는 점차 확대되고 있는 추세이며 국가부처에도 유사한 바이오모니터링 사업들이 여러가지 진행되고 있다. 본고에서는 이런 바이오모니터링 연구 또는 사업에 대해 특히 노출바이오모니터링에 대해 학술적으로 검토하고, 바이오마커 연구의 특장점과 건강위해성평가에 활용할 때 주의할 점을 지적하고자 한다. 또한, 특별히 국가단위 인구집단 바이오모니터링 사업의 중요성과 의의를 환경부의 ‘국민환경보건기초조사’(이하 ‘기초조사’)를 중심으로 고찰하면서 자료해석과 향후 발전 방향에 대한 제언을 하고자 한다.
본론
1. 바이오마커의 구분과 활용
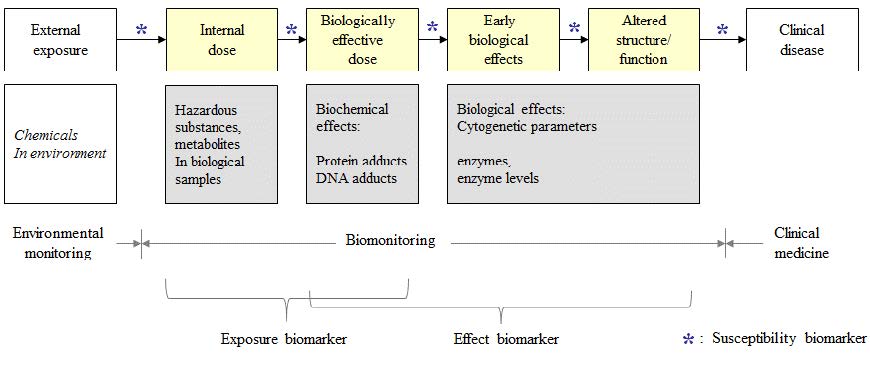
바이오마커(biomarker)란 체내에 어떤 사건(event)가 나타났음을 알려주는 지표로서 ‘생체지표’로 번역되기도 한다. 여기서 사건은 노출(exposure), 건강영향(health effect 또는 health outcomes)를 의미하기에 Figure 1의 노출-건강 연속모델[3]의 관점에서 측정될 수 있는 것들이 노출바이오마커 또는 영향바이오마커가 된다고 하겠다. 가령, 공기 중 벤젠을 흡입된 이후 날숨(exhaled breath)에서 검출되면 이는 ‘노출바이오마커’다. 날숨 중 벤젠은 원물질(parent compound)이지만, 체내에서 대사되어 다른 물질로 바뀌거나 단백질이나 DNA와 공유 결합된 산물(product; adduct이라고 부름)도 노출바이오마커(biomarker of exposure)로 기능할 수 있다. 흡수된 벤젠이 체내에서 하이드로퀴논(hydroquinone, HQ)이나 뮤콘산(tt-muconic acid, MA)으로 대사되어 소변에서 검출되는 경우인데, 이 경우 HQ과 MA이 다른 물질에 의해 생길 수도 있기에 노출바이오마커로 활용할 때 주의를 기울여야 한다[4]. 벤젠노출은 DNA-adduct을 발생시킬 수 있고, 혈구수를 줄일 수도 있다. 이와 같은 건강영향은 이화학검사를 통해 밝힐 수 있는데, 이와 같은 임상화학지표는 건강영향바이오마커(biomarker of effect)로 기능할 수 있다. 벤젠으로 인한 만성적 독성은 벤젠의 대사산물이 높은 반응성(reactivity)를 지니기 때문이다. 벤젠의 최초 대사체인 벤젠옥사이드(benzene-oxide)는 알부민이나 헤모글로빈과 결합하여 adduct을 형성할 수 있다. 벤젠옥사이드는 체내에서 합성되지 않기에 이런 adduct은 노출바이오마커로 사용할 수도 있지만 건강영향으로 가는 전임상적(pre-clinical) 과정으로 보면 영향바이오마커로도 사용할 수 있다. 그리고, 사람마다 노출에서 건강영향까지 진행하는 정도가 다를 수 있다. 가령 CYP2E1 효소를 지정하는 유전자(rs2031920)가 homologous하게 variant type이라면 그렇지 않은 사람보다 HQ를 만들어 내는 정도는 작고 이는 노출량이 커질 수록 분명하게 드러나게 된다[5]. 이와 같이 특정유전자의 유전형(genotype)은 감수성결정인자로 작용할 수 있기에 감수성 바이오마커(biomarker of susceptibility)로 기능하게 된다.
바이오마커는 한편 체내 체류시간에 따라 구분할 수도 있다. 우리 몸에 들어온 물질은 다양한 체류기간(resident time)을 가진다. 바이오마커로 활용되는 물질들도 체내 흡수 (absorption)된 후, 분배(distribution), 대사(metabolism), 및 배설(excretion) 등의 과정을 거치며 다양한 반감기를 가진다. 체내로부터 제거되는 과정(elimination process)을 1차 속도 상수(first-order rate constant)로써 나타낸다면, 동력학적으로 선형 (linear)이다. [물론 이 과정은 물질의 체내 제거(elimination)과정이 포화(saturation)되지 않을 정도의 낮은 농도에서 이루어졌다는 가정이 필요하지만, 환경 중 노출 또는 많은 작업장 노출 상황에 적용해도 큰 무리 없을 것이다].
각각의 속도 상수는 time-1로 표현되므로 값이 클 수록 다음 단계로 빠르게 이행하고, 체류 시간은 짧아지게 된다. 예를 들어 중금속의 속도상수(k)는 volatile organic compounds(VOCs)보다 작아 중금속의 체류시간(1/k)은 길다. 이렇듯 중금속은 외부 환경 중 농도 변화(day-to-day variation)보다 생체시료 중 변이가 작아 일정 시기 중 평균 노출량을 가늠하기에 좋은 특성을 가지고 있다. 반면, VOCs는 대개 상대적으로 신속히 제거되어 이런 특성은 노출에 민감하게 변화하므로 단기간 노출량의 변이를 추적하는데 유용하게 사용될 수 있다. 일반적으로 2일 내외의 체류기간을 갖는 물질은 단기 바이오마커로 구분하며, 2개월 상회하는 반감기를 가지면 장기 바이오마커로 구분하며, 일반적으로 반감기는 ln(2)/k로 구한다[6].
노출 바이오마커는 노출에 대한 정보를 알려주기에 노출평가에 유용하게 사용될 수 있다. 수영이나 육상경기 메달리스트들이나 마약복용 혐의자들에게 도핑검사를 함으로써 금지된 약물 복용여부를 알듯 흡연자와 비흡연자의 소변에서 니코틴(nicotine)의 대사체인 코티닌(cotinine)을 측정하면 직접 흡연여부뿐 아니라 간접흡연까지도 알 수 있다[7]. 이처럼 노출 여부를 직접적으로 알려줄 수 있는 장점으로 인해 설문지를 통한 오분류(misclassification)을 줄여주는 측면에서 노출평가보다 정확한 데이터를 제공할 수 있다. 이외에 다음과 같은 측면에서 활용될 수 있다.
① 전통적인 노출모델의 검증
화학물질에 대한 노출평가를 수행할 때 환경중 물질을 함유한 먼지, 공기, 토양, 식품, 물 등 매체(media)에 접촉(contact), 흡입(inhalation), 섭취(ingestion) 등 행위로 인하여 노출되어 체내로 들어오는 것을 추정하기 위해 대개 노출시나리오를 상정하고 노출계수를 이용하여 노출량을 계산한다[8]. 이런 노출량 추정방식이 잘못된 것은 아니지만 노출계수가 정확하더라도 노출시나리오에서 누락된 경우 과소평가 위험이 있고, 노출시나리오가 누구에게나 동일하게 적용될 수 없기에 일정한 노출계수는 point estimation의 한계가 있다. 이로 인해 Monte Carol 최근 시뮬레이션을 활용하여 확률론적인 접근도 시도되지만 특정 인구집단에 적합한 노출계수가 없다면 노출상황이 다른 외국 사례나 추정모델을 이용하는 수 밖에 없어 추정치의 불확실도가 증가하게 된다. 노출바이오마커는 정량적(quantitative)이며 개인특이적인 내적용량(internal dose)와 관련되어 있기에 전통적인 노출모델로 함께 활용되면 불확실도를 낮출 수 있는 장점을 제공한다. 체내 반감기가 짧은 물질의 경우 일상적으로 노출되어야 한다는 등의 약간의 가정이 필요하지만 바이오모니터링 데이터를 이용하여 외적 노출량을 pharmacokinetics 모델을 이용하여 역추정(reverse dosimet-ry)[9]하면 노출계수와 비교하여[10] 시나리오에서 누락된 부분이나 보완할 점을 확인하는데도 활용될 수 있다.
② 우선적 노출관리 대상 확인
여러 가지 화학물질이 환경 중에 존재하고 있는데 개인 또는 인구집단에서 높게 검출되는 물질중 생축적성(bio-accumulative)이 크거나 상대적으로 건강위해성이 큰 물질을 찾아낸다면 이는 어떤 물질을 관리해야할 지 알려주는 좋은 근거가 된다. 물론 이는 활용된 생체시료에서 검출되는 것에 한정되기에 노출을 제대로 반영하지 않는 검체이거나 샘플링 시점이 노출을 제대로 반영하지 못하는 경우는 제외된다.
③ 고위험군의 식별
노출바이오마커를 인구집단에서 측정하면 다양한 편차를 보이게 되는데 일반적으로 대수정규분포(log-normal distribution)의 양상을 띄며[6], bimodal 또는 경우에 따라 censoring되는 형태를 보이기도 한다. 전체분포를 살펴 높이 상대적 고노출 집단을 식별하기 위해 95분위수 이상 수치를 보이는 경우 전체집단에서 고노출군으로 선정할 수 있다. 물론 이것은 절대적인 수치는 아니지만 population-based bio-monitoring에서 통용되는 방법으로 인정받고 있어 독일의 인체바이오모니터링 위원회[11]나 US NHANES에도 참고치(reference value)로서 RV95를 중요하게 여기고 있다[1]. 또한 인구전체적으로는 저노출군이라도 영아·어린이 또는 임산부에 대해 바이오모니터링의 결과는 이들 민감군이 고위험군인지 식별하는데 귀중한 자료를 제공할 수 있다[12].
④ 통합노출량에 대한 정보 제공
노출바이오마커를 통해 검출된 것은 물질에 대한 노출을 반영한다. 특이적인 마커일 수록 정확도는 높아진다. 노출원이나 노출경로가 현재 기술과 지식으로 분명하지 않더라도 체내에서 검출된 것은 노출된 사실을 반영한다. 최근 우리나라 일반인구집단 여성을 대상으로 수행한 연구에서 직업적 노출이 없었음에도 모유와 혈액에서 PCBs가 검출된 경우가 보고되었는데[13] 이는 식이를 통해 노출될 수도 있고 태어나면서부터 모체로부터 노출되었을 수 있다.
⑤ 인구집단의 노출(exposure) 현황의 경시적 추이(time trend) 파악
환경오염물질 관리에 있어 환경오염물질의 노출량 추이가 어떤 변화가 있는지 살피는 것은 정책적으로나 학문적으로 중요한 의미를 갖는다[14]. 체내 반감기가 상대적으로 긴 물질은 바이오마커의 수준이 평균노출량을 반영하지만, 체내 반감기가 짧더라도 일상적으로 노출되면 ‘의사평형상태’(pseudo steady state)에 이르기에 평균노출량으로 간주할 수 있다[1]. 이와 같이 일정기간 중 평균노출량을 가늠할 수 있는 물질에 대해 주기적으로 관심 있는 인구집단에 바이오모니터링을 수행한 경우, 인구집단의 해당물질에 대한 평균노출량의 추이(time trend)를 파악할 수 있는 근거를 제공한다. 이 경우 대표성의 문제가 발생할 수 있기에 통계적 power를 높이기 위한 meta분석을 수행하거나 인구분포를 고려한 대표성 있는 표본선택에 유의해야 한다. 시간적 추이는 연별, 계절별로 수행될 수도 있으며 (기간이 긴 경우) 십년단위로 수행할 수도 있다.
⑥ 집단내·집단간 비교를 위한 대표값 또는 참고치의 산출
바이오마커의 농도는 그 자체가 개인의 노출량을 지시하는 것이 아니기에 개별 수치의 비교는 큰 의미를 갖지 못하는 경우가 많다. 가령, 미국의 Environmental Working Group(EWG)과 같은 NGO(Non-Governmental Organization) 에서 성인 일반인 자원자를 대상으로 혈중 수은 6.34 μg/L을 측정하였는데[15] 이는 참가자의 평균에 가까운 값이었지만 미국 NHANES (National Health and Nutrition Examination Survey) 값에 보고된 RV95(the 95th percentile for population-based reference value)는 5.4 μg/L[16]이기에 미국 전체인구집단에서 고노출군에 속한다고 할 수 있다. 하지만, 우리나라 1기 ‘기초조사’의 중위수는 성인 3.05 μg/L이고 RV95는 9.91 μg/L이기에 우리나라 사람들에 비하면 낮은 수준이다[2]. 이상에서 보듯, 체류시간이 상대적으로 길거나 노출이 일상적으로 일어나기에 바이오마커 수준이 평균노출량과 관련된 물질에 대해, 인구집단을 대상으로 바이오모니터링을 수행하면 집단 내 상대적 고노출군을 구분할 수 있는 참고치(reference value: 예, RV95)를 산정할 수 있다. 또한 통계적인 대표성이 보장될 경우 집단간 비교를 수행할 수 있다.
⑦ 노출저감과 예방 조치의 효과 평가
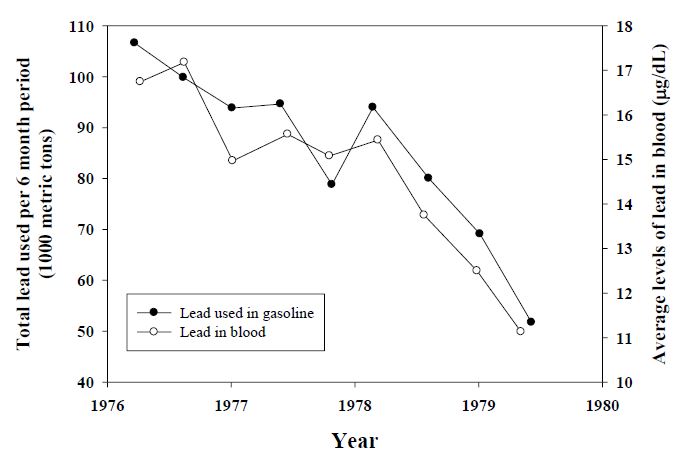
유해물질의 노출에 대한 환경 및 보건당국의 조치는 노출원과 노출경로를 제대로 파악하지 못하거나 수단이 효과적이지 못하면 효과를 발휘하지 못하는 경우가 많다. 어떤 조치를 수행한 뒤 바이오마커의 수준이 감소했다면 조치가 효력을 발휘했다고 볼 수 있기에 이는 개인적인 접근뿐 아니라 인구집단이나 특정 계층을 대상으로 수행하는 환경보건 관련 조치의 효과를 판단하는 수단이 될 수 있다. 과거 미국에서 혈중납이 높은 원인을 두고 환경과 납이 함유된 휘발유 사이에서 논란이 있었을 때, 무연휘발유 사용의 확대와 1976년에서 1980년 사이 NHANES-II를 통해 확보된 혈중 납 농도 저감이 거의 일치하는 것을 보면 노출원 관리로 무연휘발유 보급의 확대가 효과적임을 알 수 있게 한다[17]. 이후 무연휘발유의 지속적인 사용 확대되었지만, 혈중납의 수준은 특정 계층에서 저하되지 않고 유지되었다. 추가적인 조사결과 집안의 납함유 페인트가 부식되어 먼지와 함께 노출되었기 때문으로 원인을 밝혀낸 적이 보고되었다.
노출평가(exposure assessment)란 어떤 물질이 (또는 어떤 물질과 함께) 누구에게, 언제 (timing), 어떤 빈도(frequency)로, 얼마나 지속되었는지(exposure duration), 어느 기간(period)에, 어떤 노출패턴으로 즉, 연속적인지 불연속인지, 일정한 수준인지 변동이 큰 수준인지, random한지, 그리고 어디로부터 (exposure source), 어떤 매체로 (exposure media - 공기, 물, 먼지, 토양 등등), 무엇을 통해 (exposure pathways) 어떤 다른 환경조건이나 다른 요인(activity나 교육, 보호장구의 착용 여부 등)에 따라 달라지는지 등 노출의 수준뿐 아니라 노출에 영향을 주는 요인을 밝히는 노출과학(exposure science)의 한 분야이다.
① 민감도(sensitivity)와 특이도(specificity)
모든 바이오마커는 적절한 대상을 측정해야 할 뿐더러, 적정수준의 노출량 이상에서 활용가치를 지닌다. 바이오마커를 이용하여 노출량을 추정하려 할 때, 이런 원칙을 잘 이해하더라도 다른 어려움에 현장에서 부딪치는 경우가 많다. 바이오모니터링을 이용한 노출평가에서 유용한 바이오마커는 해당물질의 노출량이 많을수록 많이 검출할 수 있어야 하고 일반생활환경이나 작업환경에서 비노출 그룹에서와 같이 비교적 낮은 노출수준도 검출할 수 있는 민감도(sensitivity)가 확보되어야 한다. 한편, 바이오마커의 활용에는 적정수준이상의 특이도(specificity)의 확보도 매우 중요하다. 특이도란, 바이오마커가 식이나 환경 중 다른 오염물질 및 개인적인 기호나 생활습관(예, 흡연, 음주)에 의해 혼동되거나 교란 받을 수 있기에 특정물질 노출에 대한 변별력을 의미한다. 가령, 실내 환경에서 포름알데히드(formaldehyde)가 체내 얼마나 들어왔는지 알기 위해 요중 포름알데히드 농도를 측정하면 실제로 노출-내적용량의 양-반응관계(dose-response relationship)이 성립하지 않을 것이다. 그 이유는 포름알데히드의 높은 반응성으로 인해 체내 흡수되자 곧 다른 물질과 결합되거나 대사되어 소변 중 포름알데히드의 양은 거의 없을 것이기 때문이다. 만약 포름알데히드의 최종 대사산물(metabolite)인 포름산(formic acid)을 측정한다면 매우 높은 수준으로 검출할 수는 있을 것이다. 하지만 이 경우 외적 노출량과 소변 농도간의 상관관계가 뚜렷이 보이지 않을 가능성이 많고, 특히 낮은 농도에서는 구별이 쉽지 않을 것이다[18]. 포름산은 실내 공기 중 포름알데히드의 최종분해산물이지만, 작은 분자량(low molecular weight)의 환경 유기물질과 체내 여러 가지 단백질의 최종 분해산물로 자연스레 생겨나기도 하기 때문에 외적노출량(exogenous exposure)을 내재적 요인(endogenous sources)에서 발생한 것을 구분해낼 수 없기 때문이다. 또한 포름알데히드는 체내에서 자연적으로 형성되기도 하며 외부에서 노출된 것과 동일한 방식으로 저해를 일으키고 DNA adduct을 형성하기도 하여 환경에서 노출된 것과 구분할 수 없는 경우도 있다[19].
② 샘플링시 적절한 매체(생체시료)와 샘플링 시점의 선택
대체로 친지질성(lipophilic) 물질은 혈액(혈중 지질) 또는 지방조직에, 친수성 물질은 소변, 혈액(혈청) 또는 날숨에 존재하는 경우가 많다. 또한 소변과 혈액에서 샘플링할 때, 잔류성이 높지 않은 물질은 노출 후 하루가 지나도 ppb (part-per billion) 이하로 떨어질 수 있지만, 잔류성이 높아도 소변 중 농도가 낮기에 이에 대한 구분이 필요하다[20].
③ 노출원 및 노출정보에 대한 정보
대개 체내에서 검출되는 바이오마커에는 ‘출신성분’(sources of exposure)에 대한 표식이 없다. 따라서 노출원이 식품인지 (식품이라면 어떤 식품이었는지), 환경인지, 기타 생활요인과의 관련성을 알 수 있는 단서가 생체시료의 제공자로부터 확보되지 않을 경우, 노출원에 대한 정보를 알 수 없고, 흡입, 섭취, 경피부, 경태반 등 노출경로(pathways of exposure) 또한 알 수 없어 유해물질에 대한 차단을 위한 정책적 개입(intervention)에 지장을 초래한다. 따라서 바이오모니터링을 기획할 때 생체시료의 확보와 검출만큼이나 생체시료 제공자 개개인이 처한 노출환경에 대한 정보 확보가 대단히 중요하다.
④ 노출시점
대부분의 바이오모니터링 연구에서 검출된 바이오마커는 (실험실에서 수행된 인위적 노출이 아닌 경우) 언제 얼마나 자주 노출된 것인지 직접 알 수 없는 경우가 많다. 체내 반감기가 짧고 일정한 농도에 정해진 기간 동안 노출된 것이 아닌 경우, 언제 시료를 채취하였는지에 따라 농도가 크게 변할 수 있어 주의가 요구된다. 특히 물질의 화학적 특성에 따라 검체 중 농도나 및 변화추이(profile)가 크게 다르다. 따라서 바이오모니터링 연구의 기획단계에서 원물질(parent compound)과 대사체(metabolite) 또는 부가체(adduct) 중 어떤 것을 취할지, 샘플링하려는 시료(specimen)에서 반감기(half-life)는 어떤지, 수거 후 냉동고에 보관하는 동안 안정성(stability)은 어떠한지에 대한 반드시 확인해야 한다. 더불어 해당물질이 검체 제공자의 노출패턴(빈도, 강도 등)에 대한 정보가 반드시 확보되어야 한다. 이러한 노출량에 대한 정보 수집의 방법으로 설문지, 증례기록지 및 진료기록부, 식이섭취 다이어리 또는 식이섭취빈도조사 및 환경노출평가 등 전통적인 방법뿐 아니라 모바일 기기를 활용한 시간활동도(time activity) 조사[21] 및 exposome 기반 노출모니터링 기법[22]도 지속적으로 개발되어 활용되고 있으니 적절히 활용하면 좋겠다.
⑤ 분석기술
근래 질량분석기(mass spectrometry)의 분석기술이 대단히 빠르게 발달하고 보급도 크게 늘어나 과거에는 ‘불검출’ 또는 변별하지 못한 물질을 이제는 높은 분석능(resolution)으로 검출하고 있다. 최근에는 고형 생체시료중 대사체를 비파괴 정량하는 NMR 기술까지 보급되고 있다[23]. 이러한 기술의 발달이 바이오모니터링을 크게 도약시키는 것은 분명하지만 분석기술 자체가 바이오모니터링 및 위해성평가 자체를 결정하는 것은 아니다. 하지만, 새로운 기술의 도입과 적극적인 활용을 위한 학제적인 연구는 더욱 강화되어야 하고 그렇게 될 것으로 전망된다.
⑥ 완건성(robustness)
노출 바이오마커로서의 자격으로 외적 노출을 변별력 있게 반영하는 특이성(specificity)은 앞 절에서도 설명했지만 ‘완건성’(robustness)도 근거가 반드시 확보되어야 한다. 여기서 말하는 ‘완건성’(robustness)은 정량된 농도의 신뢰도에 해당한다. 측정법이나 측정자, 샘플링 매체, 저장 및 해동, 전처리 방법 등 측정된 농도에 영향을 줄 수 있는 요인들은 매우 많다. 만일 동일한 검체를 분석하는데 측정기관이나 분석방법마다 서로 다른 결과를 보인다면, 냉동보관중인 검체를 분석한 것이 현장에서 샘플링 할 당시의 검체수준과 같다는 믿음이 없다면, 또 시료의 수거/이동 및 전처리 과정 중에서 발생할 수 있는 오염이나 기저농도값(background levels)이 높다면 그 데이터는 믿을 수 없는 자료가 되기 때문이다.
⑦ 누적노출량 및 건강영향 관련성
유해물질에 대한 건강영향은 노출이 지속적으로 이루어질 경우 발생할 가능성이 높다. 그렇기 때문에 일정기간 동안의 평균노출량 또는 누적노출량에 대한 추정은 위해성평가에서 매우 중요하다. 바이오모니터링에서 뼈와 모발 또는 소변 중 중금속이나 혈액 중 헤모글로빈 또는 알부민-부가체(albumin adduct)는 일정기간 동안의 평균적 노출량을 반영하기에 건강영향과의 연관연구에 많이 활용되고 있다[24].
바이오모니터링은 노출이 있었음을 말해줄 수 있어도 노출 시점과 빈도 및 정도를 알려주지 않는다. 여러 노출원(exposure source)과 노출경로(exposure pathways)를 통해 노출된 것을 반영할 수 있겠으나, 반면 어떤 노출원과 경로로 각기 얼마나 체내에 들어왔는지 바이오마커의 농도만으로는 구별할 수가 없다. 또한 바이오모니터링에 활용하는 생체시료가 표적장기 및 생리적으로 중요한 기관을 거쳐 나왔지만 바이오마커의 수준이 표적장기 및 중요 장기의 그것과는 다를 수 있다. 따라서 위해도(risk)를 정할 때, 민감군을 식별할 때 또는 질병의 조기 진단을 수행할 때 실제 노출에 대한 영향과 다를 수 있음을 염두에 두어야 한다. 따라서 바이오마커를 통한 위해성평가가 여러 가지 이점을 제공하지만 전통적인 노출평가 방법론과 병행하여 이루어져야 그 효용성이 커질 수 있음을 연구설계와 결과 해석에 있어 반드시 염두에 두어야할 것이다[20]. 위해성평가를 이루는 각 module에 대해 바이오마커를 활용할 때 장점과 유의할 점을 논해보고자 한다.
① 바이오마커를 활용한 유해평가(hazard identification)
화학물질의 건강영향을 결정하기 위해 확보 가능한 데이터에 대한 실험적 분석을 함에 있어 바이오마커는 독성 기전에 대한 이해를 높일 수 있으며 건강영향에 대한 잠재적 문턱값(potential threshold)을 파악할 수 있게 한다. 정보가 충분하지 않은 경우 일반적으로 발암성 물질의 문턱값(역치)은 없다고 가정하는 것이 발암성 화학물질에 대한 위해성평가의 기본(default)이다. 하지만, 특정 화학물질의 인체 발암성에 대한 가능성을 역학자료(epidemiologic data)와 동물실험 및 기타 독성학적 기전 데이터를 포괄하여 합리적 모델을 제시하는 것도 바이오마커를 통해 가능하며 이 과정에서 관련증거의 경중을 가릴 수 있는데 이를 weight-of-evidence라고 한다[25]. 바이오마커는 노출 후 체내에서 일어나는 분자수준의 event를 다루며 기전적인 이해[26]를 도울 수 있기에 유해성(harmfulness)을 확인하는데 유용한 도움을 제공할 수 있다.
② 바이오마커를 활용한 용량-반응 분석(doseresponse analysis)
서로 다른 수준의 노출에 대한 생물학적 반응도 또는 그 확률을 정하는 데 있어, 대사(metabolism)와 독물동력학(toxicokinetics)적 정보와 함께 DNA/단백질 바이오마커는 대단히 유용한 수단(utility)으로 활용된다. 가령 위해성평가(risk analysis)에서 특정 실험동물 종(species)에 대해 인위적으로 투여된 고농도 실험결과만 존재할 경우 안전계수(safety factor)를 사용할 수도 있겠으나, 최근에는 작용양상(mode of action, MOA)이 반영된 생리학적기-약물동력학(physiologically-based pharmaco-kinetics, PBPK)을 사용하여 종간(inter-species) 독성반응의 차이나 고농도에서저농도로의 외삽(extrapolation)까지 추정하여 불확실성(uncertainty)을 줄여나가는 방식에 많은 관심과 노력이 쏟아지고 있다[9, 27].
③ 바이오마커를 활용한 노출평가(exposure assessment)
노출평가에서 바이오마커는 노출이 있었음을 직접적으로 보여줌으로써 역학연구에서 오분류(misclassification)을 줄일 수 있고 주요기관 및 분자세포 수준에서의 내적용량을 추정할 수 있게 한다고 밝혔다. 노출바이오마커를 통해 체내 흡수된 총량을 가늠할 수 있고, 여러 노출원과 경로를 알고 있는 경우 통합노출량에 대한 기여도 평가를 수행할 수 있고, 시간 경과에 따른 노출패턴의 변화와 더불어, 생활환경 및 개인위생과 습관에 따라 발생할 수 있는 노출량의 변화도 가늠해 볼 수 있을 것이다. 이를 위해서는 바이오마커의 정확한 측정만큼이나 노출관련 요인에 대한 정보를 꼼꼼히 확보하는 것이 절대적으로 필요하다.
④ 위해도결정(risk characterization)에서 바이오모니터링의 활용
위해도 결정을 위해 노출로 인한 건강무영향예측농도(환경중 농도)와 실제노출량과의 비교가 필요하다. 바이오마커의 농도만으로는 이에 대한 외적농도를 파악하기가 쉽지 않다. 외적농도에 대응하는 바이오마커의 농도가 평균노출량을 반영하되 노출이 넓은 범위에서 이루어진 용량-반응곡선이 있다면 그리고 이것이 사람에게서 관찰된 것이라면 동물실험에 대한 인체외삽을 위한 불확도계수(uncertainty factor) 적용 보다 현실적이면서 전임상적 마커를 동원할 수 있기에 매우 효율적인 방법이 될 수 있을 것이다[28]. 그러나 현실적으로 이런 데이터는 극히 제한되어 있다. 또 다른 접근법으로 생리학적 기반 독물동력학(physiologically-basedpharmacokinetic model, PBPK 모델)을 활용할 수 있다. 특정 물질에 대하여 인체 PBPK 또는 이에 상응하는 모델이 있고 인구집단에서 얻은 바이오모니터링 결과를 PBPK모델을 이용하여 외적 노출량으로 환산하고 문헌을 통해 확인된 기준노출량(Point of departure)와 비교하는 방법이다[29].
2. 전국민 바이오모니터링에 대한 환경보건학적 고찰: ‘국민환경보건기초조사’ 를 중심으로
앞 절에서 바이오모니터링에 대한 일반적인 이론을 정리해보았다면, 본 절에서는 2009년부터 우리나라 전국민을 대표하는 표본에 대해 시행된 국민환경보건기초조사(이하 기초조사)를 예로 들면서 바이오모니터링 기법의 활용에 대한 고찰을 수행해 보고자 한다.
기초조사는 2009년 시행된 환경보건법 14조에 근거하여 환경유해인자의 노출과 그로 인한 건강피해 현황을 전국적으로 환경유해인자의 생체내 농도와 건강피해 현황을 3년단위로 측정하는 사업이며 이 사업의 결과 노출에 의한 건강영향 정밀조사를 수행할 수 있게 하였다. 이법에 근거하여 국립환경과학원은 우리나라 국민 인체 내 유해오염물질 노출수준의 시공간적 분포 및 변화와 그 영향요인을 분석할 수 있는 기초자료를 제공하겠다는 목표를 세우고 제 1기(2009~2011)에 전국 인구비례 표본조사구를 추출단위로 3년 350개의 조사구에서 18명씩 참여인원을 섭외하였고, 제2기(2012~2014)는 전국 인구비례에서 가구단위 표본을 설계하고 3년 400개 조사구에서 15명씩 참여인원을 섭외하였다. 제2기는 계절적 요인까지 고려할 수 있도록 설계하였는데 조사구 설정과 참여인원의 추출은 질병관리본부가 수행하는 국민건강영양조사2의 그것과 유사하다[30]. 표본 추출방식을 간단히 요약하자면, 목표모집단은 조사시작 시점에 인접한 시점을 기준으로 인구주택총조사에서 사용한 전체 조사구중 일반가구 지역과 아파트 지역에 해당하는 일반조사구를 대상으로 하고 군대·교도시설 등 시설수용인원은 제외하였다. 조사대상인구는 인구제곱근 비례방식을 사용하였고, 조사구를 1차표본추출단위로 조사구내 가정을 2차 추출단위로 하여 가족단위 샘플링을 하여 남녀의 비율을 맞추었으며, 해안층을 따로 설정하여 인구가 적은 해안지역이 누락되는 것을 최소화하였다. 아울러 일반적으로 유해물질노출과 관련된 생활ㆍ식품 섭취 습관과 문화적 차이는 지역의 행정구역을 기준으로 차이가 나타날 수 있는 점을 고려하여 농어촌으로 구분할 수 있는 층화 기준을 추가하였다[2]. 제1기와 제2기 기초조사의 조사수행체계는 서로 유사하지만 아래 Table 2에 비교하였다.
제1기에 비해 제2기는 계절적으로 고르게 샘플링이 분배되었고 제1기가 (사)한국환경보건학회에 의뢰하여 수행되었다면 제2기부터는 국립환경과학원이 직접 수행한 것이 특이적이라고 할 수 있겠다. 그리고 제2기에는 생체시료 중 노출바이오마커의 측정뿐 아니라 일반화학검사, 혈액학검사, 지질 및 내분비검사 등 및 조기건강영향 지표로 사용할 수 있는 19종의 임상검사가 추가되었다. 1기와 달리 2기에는 가구원 확인 조사와 섭외는 전문 리서치 기관에서 수행하고 설문조사는 국립환경과학원의 설문전담요원이 권역별3인 1조로 운영되어 인구학적 특성과 식이-생활습관 및 잠재적 노출원와 경로에 대한 정보를 확보하였다[31].
기초조사가 특정 가설기반 연구에 필요한 요소를 무리하게 포함시키면 기초조사가 생산하는 자료의 대표성과 일관성 및 경시적 추이 정보 등을 올바르게 산출할 수 없게 된다. 결과적으로 문제해결형 가설기반연구도 제대로 수행되려면 기초조사의 데이터가 필요하기에 기초조사는 그 본연의 임무에 충실해야 한다.
일반적으로 바이오모니터링은 화학물질 노출로 인한 건강영향평가 및 관리에 다음과 같은 영역에서 기여한다[1]. 첫째, 감시(scoping)다. 이는 환경보건학적으로 잠재적 문제를 찾는 활동을 의미한다. 인구집단의 생체시료에서 어떤 물질이 얼마나 검출되는지 스크리닝하고 고노출군이나 고위험군을 찾고, 바이오마커의 수준을 설명하는 노출원이나 경로를 조사하는 작업이 함께 수행되어야 한다. 둘째, 현황과 경시적 추이(status and trends). 이는 인구집단내 바이오마커의 분포 특성이 어떠한지, 그리고 지역적 또는 시간적 변이가 존재하는지 파악하는 것이다. 셋째, 노출과 건강영향연구(Exposure and health research) - 위의 변이와 관련된 노출원과 노출경로를 조사하고 건강영향도 파악하는 활동영역이다. 노출평가와 바이오마커를 이용한 환경역학연구, 독성학적 기전 연구도 사례가 될 수 있다. 넷째, 위해평가 및 관리(risk assessment and management). 위해도 결정 및 지역사회나 작업장에서의 intervention 연구와 같은 위해관리 및 중재연구가 이에 해당한다. 이중 첫째와 둘째 영역은 기초조사가 효용가치를 크게 나타낼 수 있는 부문이다. 비록 기초조사에서 수행되는 바이오모니터링도 궁극적으로 환경유해물질의 노출로 인한 건강영향을 최소화하기 위한 비젼을 공유하지만 특정 문제해결형 가설기반연구(hypothesis-driven research)를 위한 바이오모니터링과는 역할을 구분하는 것이 기초조사의 취지를 살릴 수 있는 길이라고 생각한다.
① 감시(Scoping).
올바른 스크리닝과 잠재적 문재의 도출을 위해서는 현재의 샘플링과 조사방식에 대한 면밀한 검토가 필요하다.
i) 연령별 대상인구집단의 추가
현재는 20세 이상 성인을 대상으로 하고 있고, 10대 청소년과 어린이와 영유아를 포함시켜야 전국민 대표 통계량의 산출을 이룰 수 있을 것이다. 제1기, 2기 연구에서는 가구단위 샘플링을 성인 대상으로 수행하였던 반면, 소아-청소년을 대상집단에 포함시킨다면, 가구 단위 샘플링이라는 기존의 틀을 변경해야 할 것으로 생각된다. 이들 계층의 특성상 주간 또는 주말에도 학교나 학원생활을 하기에 샘플링을 강제하더라도 간접적으로 수행되거나 무응답률의 증가가 예상된다. 만약 집단별로 샘플링을 수행한다면 당연히 설계표본에 대한 가중치도 다르게 부여해야만 한다. 3년 내내 연중 2원화 샘플링을 수행하거나 3년중 1년은 소아 청소년층을, 나머지 2년은 성인층을 수행하되 각 집단별로 표본의 설계를 계층 특성에 맞게 수행하는 것이 타당하다고 생각된다.
ii) 시간활동별 특성에 대한 고려
설문조사에 시간활동(time activity)에 대한 조사[32]를 고려해봄 직하다. 이미 통계청의 시간활동 조사자료를 통해 축적된 노하우가 있지만 기초조사 바이오모니터링과 연계하여 수행하면 시간활동도가 노출원 또는 노출경로에 대한 정보를 제공할 수 있고, 설문지에 추가하여 수행하는 것이기에 큰 비용과 (관리자입장과 참여자입장에서) 노력을 소요하지 않을 것이다. 실제 통계청 생활시간 조사표[33]를 보면 기초조사 의 설문지와 통합할 수 있는 문항이 많고, 설문지가 이틀에 걸쳐 시간활동 일지를 쓰는 것인데, 기초조사 전 배포하여 검진 전날과 당일 검사직전까지 수행하면 시간활동도를 쉽게 포함시킬 수 있을 것이다.
iii) 가구단위 수집에 대한 분석
가족은 생활공유의 단위이며 혈연과 혼인으로 묶여 유전적으로 유사하거나 비슷한 생활습관과 식습관을 공유하는 경우가 많다. 제1기와 2기 기초조사는 표본 추출 시 가구단위로 수행하였는데 이는 지역별 인구비례를 반영하는 조사구내 가구 중 임의 배정된 가정에서 남녀의 성비를 맞추는 데도 큰 기여를 하였다. 하지만, 제1기 기초조사의 공식 보고서와 공개원시자료에는 가족에 대한 정보가 누락되어 있다. 개인정보를 이유로 비공개의 이유를 찾을 수 있겠지만, 유사한 연구설계를 갖고 있는 국민건강영양조사에서는 동일 가구를 구성하는 가구원이 세대주(가구주)와의 관계까지 확인할 수 있는 변수(fam_rela)를 원시자료를 공개하고 있다[34]. 향후 기초조사에도 가족단위 샘플링이 유력하기에 가족에 대한 정보를 수집하되 익명처리 후 공개하는 것이 타당하고 기존의 제1기, 2기 자료도 가족정보를 보강하여 재공개하는 것이 기초조사 본연의 기능과 자료를 이용한 연구성과물에도 기여할 것으로 생각된다.
iv) 사회변화에 대한 반영
우리사회는 빠른 속도로 변화하고 있다 1인가구가 확대되고 노년층은 점차 늘어가고 있다. 또한 식생활에서 외식의 비중이 점차 늘어 직장인은 한끼 내지 두 끼를 밖에서 해결하고 주말에도 가족끼리 동반 외식하는 경우가 늘고 있다. 생활양식은 점차 서구화되어 체형의 변화뿐 아니라 질병의 발생과 이환도 서양과 매우 유사한 경향을 띠고 있다. 특히 글로벌화된 소비 문화 면에서 새로운 제품이 개인사용자에게 일상이 된 반면, 우리나라만의 소비나 생활양식이 유지되는 측면도 혼재하고 있다. 식생활이나 공산품의 사용은 외국과 유사하지만 주거문화나 고유전통의 생활문화도 존재하는데 세대별로 큰 변이가 있다. 따라서 새로운 화학물질에 노출되거나 전통적인 환경오염물질의 노출에 변화가 있을 수 있다. 이를 위해 기존의 모니터링 대상 물질을 능동적으로 살피고, 새로운 물질의 추가를 기초조사에 반영하는 것이 필요하다. 새로운 물질의 추가는 국내외 연구나 조사를 통해 필요성이 입증된 것 중심으로, 위해성 면에서 우선순위를 정해 단계적으로 추진하는 것이 타당할 것이다.
v) 노출원과 노출경로를 찾기 위한 subpopulation 연구
노출원과 노출경로에 대한 정보를 찾기 위한 screening 연구로서 노출특성에 대한 사전정보가 있을 경우 기초조사의 참여집단 내에 작은 패널을 구축하여 기초조사보다 조금 더 자세한 노출원과 노출경로 분석에 대한 파일롯(pilot)형태의 연구를 수행하되 기초조사와는 별도로 수행하는 것으로 진행한다면 연차별, 기수별로 이루어지는 기초조사의 내용을 기초조사 수행도중에 발전시키고, 향후 노출관리의 지점을 파악하는데 큰 도움을 줄 수 있을 것이다.
② 현황과 경시적 추이(status and trends)
i) 자료의 대표성 확보를 위한 노력
국가승인통계의 가치를 갖는 기초조사이지만 제1기 기초조사의 경우 응답률이 6.8~23.7%에 머물고 있다. 2010년 인구센서스의 응답률이 9.7~21.9%임을 고려하면 많은 차이를 보이는 것 같지 않지만[2], 국민건강영양조사와 비교하면 많은 차이가 있다[34]. 무응답계층의 노출현황이 응답계층과 다르지 않다는 증가가 없기에 이에 대한 보강 조사가 기초조사 기간 중 일부지역에서만이라도 시행되어 무응답층과 응답층이 노출과 생활양식 및 바이오모니터링 결과 면에서 유의한 차이가 없음을 입증하는 노력을 수행해야 자료의 대표성을 더욱 신뢰할 수 있을 것이다.
ii) 기초조사 연구수행내용과 산출물의 일관성
기초조사가 시행된 지 이제 2사이클 (6년)이 지난 반면, 국민건강영양조사(국건영)는 공식통계로 집계된 것만 제5기 보고서가 나왔으며 15년째 운영되고 있다. 기수가 증가되더라도 기존변수가 유지되고 연차별 원시자료를 통합할 때 설계가중치의 조정방법까지 사용자지침서에 소개되어 있다. 물론 새로운 변수가 추가되고 불필요한 항목은 삭제되어 왔지만 국건영의 큰 틀은 유지되고 원시자료 구조의 일관성도 유지되 고 있다. 다만 원시자료가 공개되는 시점마다 사용자 지침서가 발간되기에 자료의 변화를 추적할 수 있다. 기초조사는 국건영의 선행경험을 잘 살려 연구수행의 일관성과 산출결과물과 원시자료구조의 일관성을 유지하는 노력을 해야 한다. 필요하다면 새로운 시도가 반영될 수 있겠지만 경시적 변화를 살필 수 있도록 자료의 일관성을 유지해야 할 것이다.
iii) 경시적 자료 축적의 필요성
이미 앞 절에서 미국의 어린이 혈중납에 대한 경시적 변화와 노출원에 대한 관리 사례[17]에서 보였듯 대표성 있고 일관성 있는 전국단위의 국가통계는 경시적으로 축적된 자료일 때 그 활용가치가 빛나게 된다. 따라서 관련 부처에서는 국가의 자산을 관리하는 자세로 기초조사가 예산의 부침에 따라 영향 받지 않도록 노력해야 할 것이다.
③ 정도관리 (quality control)
정도관리는 바이오모니터링 결과가 생체시료를 샘플링한 시점의 바이오마커 수준과 동일함을 확신시켜줄 수 있도록 관리하는 것으로 아무리 강조해도 지나침이 없겠으나 관련부처에서도 크게 신경을 쓰고 있지만, 제1기와 2기 기초조사 사업을 지켜보면서 향후 개선될 지점을 지적하는 것으로 갈음하고자 한다.
i) 중앙관리식 정도관리 샘플의 운용
큰 배치(batch)로 기지농도의 시료를 다량 만들어 실제시료 보관용 vial에 실제 샘플의 분석과 동일하게 분석될 수 있도록 하거나 여러샘플을 풀링(pooling)하여 잘 혼합한 뒤 보관용 vial에 분주하여 실샘플과 동일한게 분석될 수 있도록 해야한다. 이들 정도관리용 샘플(positive control sample for quality control)의 제조 및 운용은 국립환경과학원(과학원)이 해야하면 물질분석을 담당하는 곳에서는 실샘플과 구분할 수 없도록 blind test 또는 과학원도 핵심담당자만 내역을 알 수 있도록 double-blind test를 수행하여야 올바른 정도관리가 된다. 이를 통해 기지농도의 경우 accuracy을 pooling sample은 precision을 구하도록 하여 적정범위[35]를 벗어나면 다시 분석을 수행하거나 분석을 중단시켜야 한다. 또한 이 샘플을 다른 기수에도 일부 사용할 수 있도록 보관하면서 냉동저장에 따른 영향도 체크하여 동일 물질에 대한 기수별 측정치의 변동이 있는지 확인할 필요가 있다.
ii) 현장 공시료(field blank)의 활용
현장 공시료는 샘플링이 이루어지는 현장에서 시료수거에서 물질의 분석까지의 과정에서 발생할 수 있는 오염여부를 가릴 수 있는 정도관리 방안중 하나로서 시료수거용기나 튜브에 오염이 없는 증류수를 샘플링 현장에서 투여하고 시료수거에서부터 최종 정량분석까지 실샘플과 동일하게 처리하도록 하는 프로토콜을 정착시키도록 한다.
iii) 소변중 바이오마커에 대한 농도 보정
소변의 농도는 시점에 따라 묽기가 달라진다. 통상 소변중 크레아티닌 농도를 해당 소변중 농도에 대해 나누어주는 크레아티닌 보정을 수행하여 보정전 값과 함께 보고하여왔다. 일반적으로 성인 요중 크레아티닌 농도 정상범위(0.3~3.0 g/L)안에 들어오는 소변시료의 결과를 사용하라는 WHO가이드라인이 통용되고 있고 제1기와 2기 기초조사, US NHANES에서도 사용되어왔다. 크레아티닌은 근육의 크레아틴이 분해되어 소변으로 배설되는 산물로서 체내 근육량의 일일 대사율이 일정하기에 소변의 묽기 보정에 적당하지만 성인중에서도 남성의 요중 크레아티닌 농도가 높고 근육양이 적은 사람은 적다. 따라서 노인이나 어린이가 포함된 인구집단에서 크레아티닌으로 보정하면 보정후 값이 증폭(overestimation)되어 보이는 현상이 발생한다[36]. 이를 극복하기 위해 소변중 비중을 측정하는 방법이 권장되고 있다. 소변이 진할 수록 비중이 증가하기에 인구집단의 평균치에 대한 상대적인 비중을 보정하면 원래 농도단위를 쓰면서 묽기 보정을 할 수 있는 장점이 있다. 다만, 오랜기간 관행적으로 크레아티닌 보정법이 활용되고 보고되어 왔기에 비교목적으로 크레아티닌과 함께 비중보정을 하고 보정전 값을 함께 공개하는 방법을 추전하고자한다.
④ 자료관리체계
i) 연도별 통계작성
국건영과 같이 3년주기라도 연중 분석이 이루어지고 있기에 연도별 측정결과의 집계[34]는 현실적으로 가능하다. 2000여건씩 연도별로 분석보고서와 원시자료 DB를 제작함으로써 자료관리의 기동성과 안정적 체계운용을 도모할 수 있는 장점이 있으며, 문제 발생시 이에 대한 수정 조치도 기초조사 진행 중에 수행할 수 있으므로 연도별 통계작성을 추천한다.
ii) 전담 통계연구분과의 신설
현재 기초조사는 국립환경과학원 환경보건연구과에서 전담하고 있는데, 주무부처내 또는 별도로 기초조사연구의 DB관리와 분석을 전담하는 인력을 배치하고 생산된 DB를 분석하고, 향후 기초조사의 설계에 대한 노력을 수행하는 것이 필요하다. 제1기와 제2기 기초조사의 설계와 기본 결과 보고서 및 원시자료 최종본 작성이 (사)한국환경보건학회를 통해 이루어졌지만, 주무부처인 국립환경과학원에서 이를 전담하는 것이 업무의 통일성과 책임성 측면에서 좋겠다고 생각한다. 외부 전문가 집단에서 객관적인 시각으로 접근할 수 있겠으나 기획과 수행을 이미 환경과학원에서 하고 있기에 최종기록물의 생산도 전담하도록 하고 외부 전문가는 이를 객관적으로 검토하고 자문하는 방식이 보다 적절하다고 판단되기 때문이다.
⑤ 별도의 부가적 노력
i) 관련 법령의 정비
환경보건법 14조는 기초조사의 시행 근거가 있으나 별도 조항(15~17조)이 있는 건강조사와 혼용된 귀절 - “환경유해인자로 인한 건강피해현황, 환경성질환의 발생현황”이 있고 관련 시행령이나 시행규칙 없이 기초조사를 분장하는 국립환경과학원(과학원)이 자체적으로 목적과 사업범위를 정하여 수행하고 있다. 현재까지 법취지에 맞게 과학원이 수행해온 것은 맞지만 기초조사의 취지에 맞게 법령을 정비하여 안정적 예산 확충과 지원을 받도록 함이 사업의 안정적 수행을 위해 필요하다고 생각한다.
ii) 문제해결형 가설기반 연구와의 연계
기초조사를 수행하면서 동시에 관련 위성연구(satellite)를 병행하는 것도 생각해 볼 수 있을 것이다. 가령, 노출원별 기여도 산정이나, 노출관리지점에 대한 intervention 효능 연구 또는 건강영향관련 기전 연구 등이 그것인데, 이들 연구는 연계될 수 있더라도 기초조사의 수행과는 별도로 진행되고 수행주체도 기초조사를 전담하는 인력이 하는 것은 바람직하지 못하다. 기초조사는 기초조사로서의 목적이 있기에 이를 성취하는 최선의 노력을 하고, 다른 트랙에서 다른 주체가 병행하는 것이 타당하다고 하겠다.
결론
환경유해물질에 대한 노출과 건강을 연구하는 환경보건학 분야에서 바이오모니터링은 여러가지 장점을 지닌 방법론이다. 생체시료에서 노출을 확인하고 모델과 몇가지 가정을 사용하면 노출량도 추정할 수 있고 널리 보급된 분석장비로 인해 비전문가들도 쉽게 자료를 다룰 수 있는 시대에 있다. 그러나 어떤 생체시료에서 바이오모니터링을 통해 검출되지 않았다고 해서 비노출을 의미하지 않을 수 있고 검출되었지만 외적 노출량이나 건강영향과 관련없을 수 있기에 이에 대한 해석에 주의를 기울여야 한다. 무엇보다 관련 물질의 물성에 따라 적절한 매체가 달라질 수 있고 체내 체류기간이나 노출양상 및 시점에 대한 세심한 배려가 필요하다. 또한 올바른 정도관리와 해당 인구집단의 특성 및 노출원과 노출경로, 생활습관 등 노출에 관련된 꼼꼼한 정보확보만이 바이오모니터링을 통해 얻은 정보를 올바르게 해석할 수 있다. 인구집단에 대한 전국적인 모니터링으로 국립환경과학원이 수행하고 있는 국민환경보건기초조사는 환경유해물질에 대한 전국민 대푯값 산출과 연령별 지역별 분포를 산출하는 귀한 자료이다. 기초조사의 본분에 충실하기 위해 감시(scoping)와 현황 및 경시적 추이 산출을 위한 나름의 대안을 제시하였다.
Acknowledgments
이 연구는 China Medical Board(CMB)와 서울대학교 보건연구재단의 지원으로 수행되었습니다
Notes
References
- National Research Council (U.S.), , Committee on Human Biomonitoring for Environmental Toxicants. Human biomonitoring for environmental chemicals, Washington, DC, National Academies Press, (2006), xxi, p291.
- (사)한국환경보건학회, , 제1기('09 ~'11) 국민환경보건기초조사 조사자료 통합분석 및 국가통계 산출 방안 마련, 국립환경과학원, (2011).
-
Schulte, PA., A conceptual framework for the validation and use of biologic markers, Environ Res, (1989), 48(2), p129-144.
[https://doi.org/10.1016/S0013-9351(89)80029-5]

-
Kim, S., Vermeulen, R., Waidyanatha, S., Johnson, BA., Lan, Q., Rothman, N., Smith, MT., Zhang, L., Li, G., Shen, M., Yin, S., Rappaport, SM., Using urinary biomarkers to elucidate dose-related patterns of human benzene metabolism, Carcinogenesis, (2006), 27(4), p772-781.
[https://doi.org/10.1093/carcin/bgi297]

- Kim, S., Lan, Q., Waidyanatha, S., Chanock, S., Johnson, BA., Vermeulen, R., Smith, MT., Zhang, L., Li, G., Shen, M., Yin, S., Rothman, N., Rappaport, SM., Genetic polymorphisms and benzene metabolism in humans exposed to a wide range of air concentrations, Pharmacogenet Genomics, (2007), 17(10), p789-801, exposure assessment. El Cerrito, CA, U.S.A.: Rappaport, S.M.; 2008.
- Rappaport, SM., Kupper, LL., , Quantitative Updated Tables, (2011, February), [cited 2012 2012.11.07], Available from: http://www.cdc.gov/nchs/nhanes.htm.
- Sexton, K., Adgate, JL., Church, TR., Hecht, SS., Ramachandran, G., Greaves, IA., Fredrickson, AL., Ryan, AD., Carmella, SG., Geisser, MS., Children's exposure to environmental tobacco smoke: using diverse exposure metrics to document ethnic/racial differences, Environ Health Perspect, (2004), 112(3), p392-397.
- 장재연, 조수남, 김소연, 김선자, 정해관, 한국노출계수핸드북: Korean exposure factors handbook, 서울, 환경부, (2007).
-
Tan, YM., Liao, KH., Clewell, HJ., 3rd. Reverse dosimetry: interpreting trihalomethanes biomonitoring data using physiologically based pharmacokinetic modeling, J Expo Sci Environ Epidemiol, (2007), 17(7), p591-603.
[https://doi.org/10.1038/sj.jes.7500540]

- 최경호, 생활공감 유해물질의 매체통합위해성평가(III) - Bisphenol A (BPA), 국립환경과학원 용역연구개발과제 최종보고서, NIERSP2013-144, (2013).
-
Schulz, C., Angerer, J., Ewers, U., Kolossa-Gehring, M., The German Human Biomonitoring Commission, Int J Hyg Environ Health, (2007), 210(3-4), p373-382.
[https://doi.org/10.1016/j.ijheh.2007.01.035]

-
Berglund, M., Larsson, K., Grander, M., Casteleyn, L., Kolossa-Gehring, M., Schwedler, G., Castano, A., Esteban, M., Angerer, J., Koch, HM., Schindler, BK., Schoeters, G., Smolders, R., Exley, K., Sepai, O., Blumen, L., Horvat, M., Knudsen, LE., Morck, TA., Joas, A., Joas, R., Biot, P., Aerts, D., De Cremer, K., Van Overmeire, I., Katsonouri, A., Hadjipanayis, A., Cerna, M., Krskova, A., Nielsen, JK., Jensen, JF., Rudnai, P., Kozepesy, S., Griffin, C., Nesbitt, I., Gutleb, AC., Fischer, ME., Ligocka, D., Jakubowski, M., Reis, MF., Namorado, S., Lupsa, IR., Gurzau, AE., Halzlova, K., Jajcaj, M., Mazej, D., Tratnik, JS., Lopez, A., Canas, A., Lehmann, A., Crettaz, P., Hond, ED., Govarts, E., Exposure determinants of cadmium in European mothers and their children, Environ Res, (2014).
[https://doi.org/10.1016/j.envres.2014.09.042]

-
Lee, S., Kim, S., Lee, HK., Lee, IS., Park, J., Kim, HJ., Lee, JJ., Choi, G., Choi, S., Kim, S., Kim, SY., Choi, K., Kim, S., Moon, HB, Contamination of polychlorinated biphenyls and organochlorine pesticides in breast milk in Korea: time-course variation, influencing factors, and exposure assessment, Chemosphere, (2013), 93(8), p1578-1585.
[https://doi.org/10.1016/j.chemosphere.2013.08.011]

- 환경부, 환경백서, (2013).
- EWG, The Human toxome project, (2014, Mar, 01).
- CDC, Fourth National Report on Human Exposure to Environmental Chemicals.
- Sexton, K., Callahan, MA., Bryan, EF., Estimating exposure and dose to characterize health risks: the role of human tissue monitoring in exposure assessment, Environ Health Perspect, (1995), 103 Suppl 3, p13-29.
- Schiwara, HW., Siegel, H., Goebel, A., Increase and decrease in formic acid concentration in urine samples stored at room temperature, European journal of clinical chemistry and clinical biochemistry : journal of the Forum of European Clinical Chemistry Societies, (1992), 30(2), p75-79.
-
Swenberg, JA., Lu, K., Moeller, BC., Gao, L., Upton, PB., Nakamura, J., Starr, TB, Endogenous versus exogenous DNA adducts: their role in carcinogenesis, epidemiology, and risk assessment, Toxicol Sci, (2011), 120 Suppl 1, pS130-145.
[https://doi.org/10.1093/toxsci/kfq371]

- DeCaprio, AP., Toxicologic biomarkers, New York, Taylor & Francis, (2006), xii, p295.
-
Kim, T., Lee, K., Yang, W., Yu, SD., A new analytical method for the classification of time-location data obtained from the global positioning system (GPS), J Environ Monit, (2012), 14(8), p2270-2274.
[https://doi.org/10.1039/c2em30190c]

-
Rappaport, SM., Barupal, DK., Wishart, D., Vineis, P., Scalbert, A., The blood exposome and its role in discovering causes of disease, Environ Health Perspect, (2014), 122(8), p769-774.
[https://doi.org/10.1289/ehp.1308015]

-
Lee, YK., Park, EY., Kim, S., Son, JY., Kim, TH., Kang, WG., Jeong, TC., Kim, KB., Kwack, SJ., Lee, J., Kim, S., Lee, BM., Kim, HS., Evaluation of cadmium-induced nephrotoxicity using urinary metabolomic profiles in sprague-dawley male rats, J Toxicol Environ Health A, (2014), 77(22-24), p1384-1398.
[https://doi.org/10.1080/15287394.2014.951755]

-
Rappaport, SM., Smith, MT., Epidemiology, Environment and disease risks, Science, (2010), 330(6003), p460-461.
[https://doi.org/10.1126/science.1192603]

- EPA, Guidelines for Carcinogen Risk Assessment, Agency USEP editor, Washington, DC, (2005).
-
Rothman, N., Bhatnagar, VK., Hayes, RB., Zenser, TV., Kashyap, SK., Butler, MA., Bell, DA., Lakshmi, V., Jaeger, M., Kashyap, R., Hirvonen, A., Schulte, PA., Dosemeci, M., Hsu, F., Parikh, DJ., Davis, BB., Talaska, G., The impact of interindividual variation in NAT2 activity on benzidine urinary metabolites and urothelial DNA adducts in exposed workers, Proc Natl Acad Sci U S A, (1996), 93(10), p5084-5089.
[https://doi.org/10.1073/pnas.93.10.5084]

-
Clewell, HJ., Andersen, ME., Applying mode-ofaction and pharmacokinetic considerations in contemporary cancer risk assessments: an example with trichloroethylene, Crit Rev Toxicol, (2004), 34(5), p385-445.
[https://doi.org/10.1080/10408440490500795]

- Rappaport, SM., Waidyanatha, S., Qu, QS., Shore, R., Jin, XM., Cohen, B., Chen, LC., Melikian, AA., Li, GL., Yin, SN., Yan, HF., Xu, BH., Mu, RD., Li, YY., Zhang, XL., Li, KQ., Albumin adducts of benzene oxide and 1,4-benzoquinone as measures of human benzene metabolism, Cancer Research, (2002), 62(5), p1330-1337.
-
Clewell, HJ. 3rd, The application of physiologically based pharmacokinetic modeling in human health risk assessment of hazardous substances, Toxicol Lett, (1995), 79(1-3), p207-217.
[https://doi.org/10.1016/0378-4274(95)03372-R]

- 박충희, 유승도, 국민환경보건기초조사의 현황 및 전망, J Environ Health Sci, (2014;), 40(1), p1-9.
- 국립환경과학원, 제2기 국민환경보건기초조사 발대식 자료집, 환경보건연구과 국, editor, 경기도 과천시, (2012).
- 이현수, 솨이지엔페이, 우병렬, 황문영, 박충희, 유승도, 양원호, 직장인의 시간활동 양상평가, 한국산업위생학회지, (2010), 20(2), p102-110.
- 통계청, 생활시간조사, [cited 2014 2014. 12.10], Available from: http://kostat.go.kr/survey/lifestyle/index.action.
- 질병관리본부, , 국민건강영양조사 원시자료 이용지침서 - 제 5기(2010-2012), 보건복지부/질병관리본부, editor, 경기도 과천시, (2014).
- NiTR, , Biological method validation (Korean), Administration NIoTRKfaD, editor, Seoul, (2010).
-
Barr, DB., Wilder, LC., Caudill, SP., Gonzalez, AJ., Needham, LL., Pirkle, JL., Urinary creatinine concentrations in the U.S. population: implications for urinary biologic monitoring measurements, Environ Health Perspect, (2005), 113(2), p192-200.
[https://doi.org/10.1289/ehp.7337]