식품 중 잔류동물용 의약품 분석기술 동향
Abstract
Today, antibiotics are routinely fed to livestock, poultry, and fish on industrial farms to promote faster growth and to compensate for the unsanitary conditions in which they are raised. However, excessive use of antibiotics may encourage specific germs to develop resistances to them. The use of low doses of antibiotics by the modern food animal industry is responsible for drug-resistant bacteria emerging on farms which reach the general population through human or animal carriers, and through the food consumers eat. Antibiotic-resistant bacteria are a growing public health crisis because infections from resistant bacteria are increasingly difficult and expensive to treat. The intensive animal farming and mass breeding system makes animals more vulnerable to infection. Therefore, it is important to monitor the levels of veterinary drug residue in foods to protect public health. In this study, we reviewed the recent trend analysis of veterinary drugs in various food matrices. Important point in the monitoring of veterinary drug residues is the analytical quality assurance with efficiency. Our review found that current trend of residue analysis is a fast multiresidue method for the determination of veterinary drug residues in food samples using QuECheRS(Quick, Easy, Cheap, Effective, Rugged and Safe) base method with highly sensitive devices such as LC-MS/MS and LC-TOF/MS.
Keywords:
Veterinary drug residues, LC-MS/MS, solid phase extraction (SPE)1. 서론
동물용의약품(Veterinary drug)은 가축, 가금, 수산물 등의 질병예방 및 치료, 성장촉진 및 사료효율 개선을 위해 전 세계적으로 사용되고 있다.
국내에서 사용되는 항생제 성분은 테트라사이클린계(tetracyclines), 페니실린계(penicillines), 설파제계(sulfonamides), 페니콜계(phenicols), 이오너포어계(ionophores), 마크로라이드계(macrolides), 아미노글리코사이드계(aminoglycosides), 퀴놀론계(quinolones), 플레우로무틸린계(pleuromutilins), 폴리펩타이드계(polypeptides), 세파계(cephemes), 린코사마이드계(lincosamides) 등 이다. 국내에서 가장 많이 사용되는 동물용의약품은 항생제 및 합성항균제이고, 2007년 항생제 사용량 감소를 위한 제도가 마련됨에 따라 1,500톤 내외로 사용되던 항생제의 사용량은 2014년 634톤으로 지속적으로 감소 추세를 보이고 있다. 2011년 배합사료 내 항생제 첨가금지로 인해 항생제 사용의 90%는 자가치료용이고, 테트라사이클린계와 페니실린계가 각각 160톤 이상으로 가장 많이 판매된 것으로 조사되었다. 대부분의 항생제의 판매량이 감소하고 있지만 페니콜계와 셀파로스포린계의 판매량은 점차 증가하고 있다(농림부, 2015). 특히 밀집사육을 하는 국내 축산업의 특성상 안전하고 경제적으로 식육을 제공하기 위해서 항생제의 적정 사용은 필수 불가결하다. 그러나 의약물질은 생리학적 작용특성 때문에 밀집사육 시 사료를 통해 비표적 동물에게 부정적 영향을 초래할 가능성이 있으며, 궁극적으로 식품 내 남아있게 된다(Clarke et al., 2014).
2012년 미국 질병통제예방센터(centers for disease control and prevention, CDC)는 추적 조사한 결과 미국 내 식품 매개 항생제 내성균 감염으로 약 430,000건의 질병사례가 발생하고, 식품이나 급원식품으로 유래한 다약제 내성 살모넬라균은 매년 약 100,000건의 질병사례를 보였음을 발표하였다. 이에 CDC 는 내성 세균의 문제를 ‘긴급을 요하는 공공 보건의 문제(public health issue of some urgency)’로 보고 있다(CDC, 2014).
2014년 농림부의 가축 및 도축장 도체 유래 세균의 항생제내성을 조사한 결과 지표세균인 Escherichia coli (E. coli) 에서 테트라사이클린(tetracycline), 스트렙토마이신(streptomycin), 암피실린(ampicillin)의 내성이 높았으며 대체로 소고기에 비해 돼지고기와 닭고기에서 높게 나타났다. 또한 식중독세균인 살모넬라균의 다제내성률은 항생제 및 축종별로 다소 차이는 있었으나 대체로 닭 유래 균주에서 높게 나타났으며 세포티어(ceftiofur)의 내성은 닭(37.8%) 및 닭 도체(50.9%)에서 높게 나타났다(농림부, 2015).
이처럼 항생제의 광범위한 사용은 항생제 내성 문제를 발생시킨다. 이에 주요국가 및 국제식품규격위원회(CODEX Alimentarius Commission)에서는 최대잔류허용기준치(maximum residue level, MRL)를 설정하여 식품에 존재하는 동물용의약품의 잔류량을 규제하고 있다. 현재 국내에서는 147종의 동물용의약품에 대한 잔류허용기준을 설정하여 지속적으로 안전관리를 수행해오고 있다(식약처, 2015). 그러나 식품의 세계화, 많은 수의 다양한 동물용의약품, 분석기기의 개선으로 인해 국제적으로 잔류동물용의약품에 대한 기준이 엄격해지고 있으며 식품의 안전관리 강화를 위해 잔류분석법의 개선이 이루어지고 있다. 이에 식품 중 잔류동물용의약품에 대한 최근 분석기술 동향에 대해 살펴보고자 한다.
2. 분석기술 현황
1) 전처리 방법
샘플을 분석하기 전까지 가장 중요한 고려요인은 저장방법과 샘플의 균질화이다. 샘플의 저장은 샘플을 채취하고 분석하기까지 지체되는 시간(lag time) 때문에 중요하다. 어떤 미생물은 페니실린을 분해하여 활성을 감소시키는 효소인 penicillinase 를 생성하여 신장의 페니실린 농도를 낮추는 역할을 한다. 그러므로 시료를 저장할 때는 물리적, 화학적 요인(산화 및 단백질 분해 등)과 생물학적 요인(미생물 및 효소반응 등)에 대해 고려해야 한다(Kinsella et al., 2009). 또한 샘플은 전체를 대표할 수 있는 일부를 채취하는 것이므로 단일 샘플 중 분석 대상물질은 균질하게 존재해야만 분석된 농도 값을 대표 값으로 인정할 수 있다.
일반적으로 잔류동물용의약품에 대한 잔류실태를 조사하기 위해 채취하는 식품은 축•수산물 및 가공품(우유, 달걀), 벌꿀 등을 포함한다. 가축 및 가금 샘플은 식용으로 사용되는 가식부 위주로 각 표적 장기 별(근육, 간, 신장, 지방)로 구입하여 polyethylene bag 에 개별 포장하여 아이스박스에 담아 실험실로 운송하여 24시간 내에 각각 균질하게 갈아 낱개 포장 및 밀봉하여 분석 전까지 –20 ℃ 냉동 보관한다. 우유와 달걀은 동결건조 한 후 낱개 포장 및 밀봉하여 분석 전까지 냉동 보관하거나 분석 전에 바로 구입하여 분석한다.
식품은 다성분, 복잡한 매질(matrix)로 이루어져있어 분석하고자 하는 대상물질이 다른 물질에 가려져 보이지 않거나 완전 분리가 되지 않는 경우가 많아 분석하기 까다롭다. 그러므로 대상물질을 고감도로 검출하고 정량하기 위해서 대상물질의 분석을 방해하는 물질을 제거하는 것이 중요하다.
대체적으로 식품 중 잔류동물용의약품은 액-액 추출법(liquid–liquid extraction, LLE)과 고상추출법(solid phase extraction, SPE)을 통해 대상물질을 추출하고 정제하여 분석한다. LLE 는 대상물질이 서로 섞이지 않는 두 용매간 분배계수의 차이를 이용하여 대상물질을 추출하는 것이고, SPE는 충전제가 채워져 있는 실린지 모양의 카트리지에 용액상태의 샘플을 통과시켜 대상물질을 선택적으로 포집한 후 유기용매로 추출하는 것이다. 일반적으로 시료로부터 함께 추출되는 간섭물질은 대부분 대상물질과 유사한 특성을 가진 미지의 화합물들이므로 대상물질과 간섭물질간의 분리 확률을 높이기 위해서 예를 들면, LLE 후 SPE 식으로 서로 다른 분리 원리를 적용한다(식약처, 2014). 그러나 LLE 는 선택성은 우수하나 조작상의 불편함, 많은 조작시간 소요, 불안정한 회수율 등의 단점으로 그 대안으로 시료 고체상분산법(matrix solid-phase dispersion, MSPD)과 QuEChERS (Quick, Easy, Cheap, Effective, Rugged and Safe)의 사용이 증가하고 있다.
MSPD 는 실리카 표면에 화학적 처리를 한 분산체(C18, C8 등)를 사용하여 샘플을 반 건조상태로 한 후 유기용매로 추출 및 정제하는 방법으로 유기용매가 적게 소요되고, 단백질 침전단계 및 원심분리 단계가 불필요하여 전처리 시간을 줄일 수 있는 장점이 있다(Barker et al., 1989).
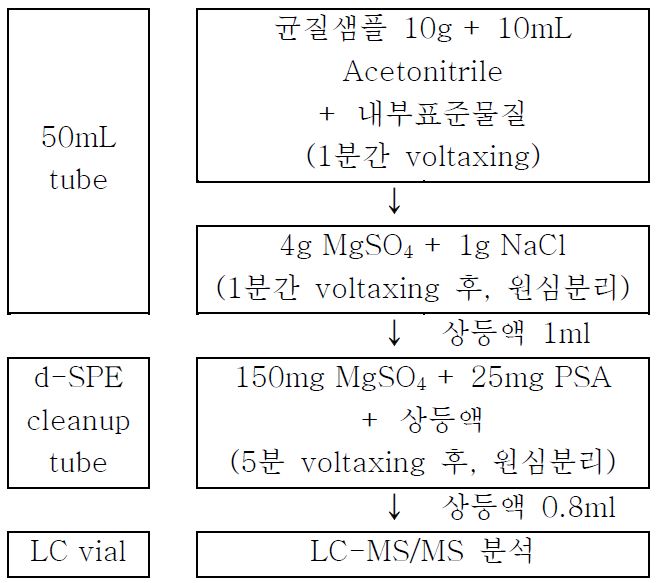
QuEChERS 는 절차의 간편함, 전처리 시간 단축, 분석물질 및 매질에 따라 분석법의 수정이 가능한 점 때문에 최근에 많이 사용되고 있다. QuEChERS 은 LLE 와 분산 고체상추출법(dispersive SPE, d-SPE)을 결합한 방법으로 식품 및 농산물에 잔류하는 농약을 빠르게 스크리닝하기 위해 개발되었다 (Anastassiades et al. 2003). QuEChERS 는 균질샘플에 유기용매와 완충염 (무수 황산마그네슘, 염화나트륨 등) 을 넣어 혼합하면 염과 극성 방해물질을 포함하는 수층과 대상물질을 포함한 용매층의 분리가 이뤄진다. 분리한 용매층에는 대상물질 외에 비극성 방해물질이 공존하므로 d-SPE tube(C18, C8등의 분산체로 충진된 튜브)를 통과시켜 방해물질을 정제 및 제거한다. 일부 QuEChERS 는 추출 단계에서 버퍼를 추가한다. 현재 가장 일반적인 2가지 방법은 추출에 구연산염 버퍼를 사용하는 European Committee for Standardization (CEN method 15662) 와 아세트산 버퍼를 사용하는 Association of Analytical Communities (AOAC method 2007.01) 이다. 상용화된 DisQuE dispersive 시료 전처리 추출 제품은 공인분석법과 프로토콜에 따라 흡수제와 버퍼가 간편하게 pre-package 되어 있어 조작의 간편함과 전처리 시간을 줄여주는 장점을 가진다.
그러나 QuEChERS 가 가장 좋은 전처리 방법을 의미하는 것은 아니다. Perez-Burgos et al. (2012) 의 연구에 의하면 소고기 근육에서 세팔로스포린계(cephalosporins)를 분석하기 위해 SPE 와 QuEChERS 를 비교한 결과 회수율은 QuEChERS (65~100 %) 가 SPE(18~87 %) 보다 더 좋았으며 LOQ 는 SPE(0.1~10 ug/kg) 가 QuEChERS (1.5~50 ug/kg) 보다 더 낮은 값을 보였다.
최근에는 잔류동물용의약품을 모니터링 하기 위해서 선택되었던 식품군의 범위도 분유, 치즈, 요거트 등 낙농제품으로 확대되고 있으며(Pérez et al., 2013; Iezzi et al., 2014; Dasenaki & Thomaidis, 2015; Furlani et al., 2015) 기존분석법으로 검출한계 이하였던 잔류물질까지 분석이 가능해지면서 모니터링 해야 하는 대상 식품 및 대상물질의 수가 과거에 비해 방대해졌다. 이에 따라 신뢰성만큼 분석과정에서의 시간 및 비용 절약도 중요해지고 있다. 이런 필요성에 따라 최근 on-line SPE 자동화 시스템도 개발되었다. on-line SPE 는 GC 및 LC 에 장착하여 SPE 전처리 후 바로 시료 주입까지 원스톱(one-stop)으로 진행되고 소프트웨어를 통해 기존 수동식 SPE 에서의 과정을 자동화하여 높은 회수율과 재현성 있는 결과를 제공하는 장점 때문에 on-line SPE 의 사용이 증가하고 있다.
2) 기기분석
식품에 잔류하는 동물용의약품 수준에 대한 안정성을 확보하기 위해서는 정확하고 신뢰성 있는 분석법이 중요하다. 잔류동물용의약품을 분석하기 위해서는 MRL 이하를 충분히 검출할 수 있을 정도의 높은 감도와 분석 결과가 대부분 공공의 목적으로 사용되므로 높은 신뢰성을 요구한다. 식품 중 잔류동물용의약품의 허용기준은 대략 0.0001~20 mg/kg 범위이고, 분석목적에 따라 분석법 기준은 다소 상이하나 대체적으로 정량한계 0.01 mg/kg 이하 또는 MRL 의 1/2(잔류허용 기준이 0.05 mg/kg 이하인 경우), 회수율 60~120 %, 분석오차 20~30 % 이하이다(식약처, 2014).
분석 기기 중 일반적으로 LC-MS는 컬럼의 선택, 이동상의 조합 등에 의하여 여러 가지 분리기술과 검출기의 조합이 가능하여 다양한 극성 물질 분석 및 대사체 분석에 용이하게 사용될 수 있다. 또한 고감도 분석이 가능하여 소량의 샘플로부터 분석 대상물질의 많은 정보를 얻을 수 있다. 이에 최근에는 높은 감도와 정밀성을 갖는 LC-MS/MS, LC-TOF/MS, UHPLC/ESI Q-Orbitrap, HPLC-MS/MS, UHPLC-MS/MS 를 사용하여 계열별 미량의 다성분을 동시 분석한다.
가축 및 가금을 대상으로 한 연구를 살펴보면 Fan et al. (2014) 는 소고기에서 10종의 스테로이드 호르몬계를 MSPD 로 추출 및 정제 한 후 UPLC-MS/MS로 분석하였다. 그 결과, LOD 는 0.01 μg/kg 및 RSD 는 10 % 이하였다. Schneider et al. (2015) 는 소고기에서 131종 (13계열)의 잔류동물용의약품에 대해 filter-vial d-SPE로 전처리 한 후 HPLC-MS/MS 로 분석하였다. Filter-vial d-SPE 는 LC 또는 GC vial 안에 필터가 들어가 있어 별도의 여과로 인한 샘플 손실을 막아준다. 분석 결과 거의 모든 샘플에서 LOQ 는 10 ng/g 이하였고 3-day validation 검사에서는 100개의 대상물질에 대해 회수율이 70~120 % 였다. Wei et al. (2015) 는 돼지, 소, 닭고기에 존재하는 128종의 항기생충제 및 대사체를 스크리닝 하기 위하여 d-SPE 로 전처리하였고 HPLC-MS/MS 로 분석하였다. 그 결과 대부분의 대상물질에 대한 LOD 의 범위는 0.5~10 ug/kg 였다. Kang et al. (2015) 는 돼지, 소, 양고기에서 55종 (5계열) 의 잔류동물용의약품을 검출하기 위하여 QuEChERS 로 전처리하고 HPLC-MS/MS 로 분석하였다. 그 결과 89.1 % 의 매질에서 회수율은 70~120 % 였고, 측정 반복성과 재현성은 94.1 % 와 90.3 %, 각 매질별 LOQ 는 돼지고기 및 양고기는 0.1~18.4 ug/kg, 소고기는 0.1~20.0 ug/kg 이었다. Donna et al. (2015) 는 소고기에서 8종의 케토스테로이드 (ketosteroid) 호르몬계열을 분석하기 위해 메탄올과 헥산을 이용하여 추출하고 SPE 카트리지로 정제 후, UHPLC-MS/MS 로 분석하였다. 그 결과 LOQ는 0.25~0.47 ug/kg, 회수율은 60~70 %, intra RSD 는 6.84~13.54 % 였다. Yunin et al. (2015) 은 소간에서 6종의 호르몬을 분석하기 위해 4시간 효소 가수분해, Methyl tert-butyl ether (MTBE) 로 추출, SPE 카트리지로 정제 후, LC-MS/MS 로 분석하였다. 회수율은 85~118 % 였고 매질효과는 알파-노르테스토스테론(α-nortestosterone)을 제외하고는 1~5 % 로 무시할 정도로 작았다. 또한 전처리과정을 수정하여(가수분해 생략) 소고기와 혈청 (serum)을 분석한 결과 회수율은 소고기 100~122 %, 혈청 95~119 % 로 소간보다 더 정확성을 보였다.
수산물을 대상으로 잔류동물용의약품을 분석한 연구를 살펴보면, Sun et al. (2012)는 수산물에서 플루오로퀴놀론계(fluoroquinolones)와 설폰아마이드계(sulfonamides)를 분석하였다. 고온, 고압 하에서 수행하는 액체 추출법인 자동 Accelerated solvent extraction (ASE) 시스템으로 전처리를 하고, 3D CE system으로 분석하였다. LOQ 는 70~100 ug/kg, 회수율은 83~106 %, intra RSD 및 inter RSD 는 각각 2.3~4.9 %, 3.1~6.5 % 였다. Lombardo-Agüí et al. (2015) 는 농어, 송어, 메기, 철갑상어에서 8종의 퀴놀론계를 분석하기 위해서 QuEChERS 로 전처리하고 UHPLC-FL 로 분석하였다. 그 결과 LOD 는 0.1~4.7 ug/kg, 회수율은 72~108 % 이였다. Dasenaki & Thomaidis (2015) 는 먹도미와 농어에서 115종의 항생제를 분석하였는데 전처리방법으로는 고-액추출법(solid–liquid extraction, SLE)을 사용하였고 LC-MS/MS 로 분석하였다. 그 결과, 회수율은 펜벤다졸(Fenbendazole)과 톨페남산(Tolfenamic acid)을 제외하고 54.9~101 %, LOQ 는 히드로클로르치아지드(hydrochlorthiazide)과 다노플록사신(danofloxacin)을 제외하고 5 ug/kg 이하였다. 우유에서 잔류동물용의약품을 분석한 연구를 살펴보면, Ehling & Reddy (2013) 는 호르몬을 측정하기 위해 QuEChERS 로 전처리 한 후 LC-MS/MS 로 분석하였다. 그 결과 RSD 는 2% 이하, 기질영향은 15 % 이하, 디에틸스틸베스트롤(diethylstilbestrol)를 제외하고 LOD 는 0.1 ∼ 0.8 μg/kg 이었다. Freitas et al. (2014) 는 5종의 항생제 물질을 분석하기 위해 QuEChERS 로 전처리하고 LC-TOF/MS 로 측정한 결과, 평균 회수율은 83~92 % 였고, intra RSD 는 9% 이하, inter RSD 는 11% 이하, LOD 는 0.0075~1.92 ug/L 였다. Wang et al. (2015) 는 125종 (12계열) 의 잔류동물용의약품을 분석하기 위해 수정된 salting-out supported liquid extraction (SOSLE) 법과 SPE 를 사용하여 추출 및 정제를 한 후 UHPLC/Q-Orbitrap 으로 분석하였다. 그 결과 아미노글리코사이드계(aminoglycosides)를 제외하고 LOQ 는 1 ug/kg 로 정량 및 스크리닝이 가능한 것으로 보고하였다.
달걀을 대상으로 한 연구를 살펴보면, Moloney et al. (2012) 는 달걀 및 가금 고기를 대상으로 20종의 항콕시듐제를 분석하기 위해 아세토나이트릴로 추출하고 실린지 필터로 여과 후 UHPLC-MS/MS 로 분석한 결과, 측정의 반복성은 68~ 129 %, 재현성은 75~123 %, 정밀성은 달걀에서 2.3~19.7 %, 가금 고기에서 2.6~23.6 %, LOQ 는 이미도캅(imidocarb) 10 ug/kg, 톨트라주릴(toltrazuril)과 그 대사체 50 ug/kg 을 제외하고 1 ug/kg 이였다. Bilandžić et al. (2015) 은 7일간 설파모노메톡신(sulfamonomethoxine, SMM)와 트리메소프림(trimethoprim, TMP)의 혼합 농도 8 g/L 와 12 g/L 를 각 물에 섞어서 닭이 마시게 한 후 낳은 달걀의 노른자와 흰자에 잔류하는 각각의 농도를 검출하였다. 전처리는 LLE 로 추출한 후 SPE 로 정제, 0.45 um 실린지 필터로 여과하였고, LC-MS/MS로 분석하였다. 그 결과 노른자의 SMM 값은 노출 후 16일이 되었을 때 LOD (1.9 ug/kg) 보다 낮아졌고, TMP 의 값은 37일 이후에도 LOD (0.3 ug/kg) 보다 높은 값이 검출되었다. 이 연구는 비록 주입농도가 고농도의 영향도 있겠지만 SMM과 TMP의 잔류량이 한 달 이상은 되어야 달걀 내 항생제 잔류수준이 안전할 수 있음을 보여주는 연구였다.
벌꿀을 대상으로 한 연구를 살펴보면, Aguilera-Luiz et al. (2013) 는 40종의 항생제를 측정하기 위해 벌꿀을 0.1M Na2EDTA (pH 4)로 희석한 후, 자동 SPE 샘플러를 이용하여 전처리를 수행하고 UHPLC-Orbitrap/MS 로 분석하였다. 분석 결과, 회수율은 68~121 %, 재현성 및 정밀성은 모든 대상물질에서 25% 이하였다. LOQ 는 5~50 ug/kg, LOD 는 0.1~50 ug/kg 이였다. Shendy et al. (2016) 은 4종의 니트로푸란 대사체 (nitrofuran metabolites) 와 나이트로이미다졸(nitroimidazole)을 QuEChERS 로 전처리하고 LC-MS/MS 로 분석하였다. 그 결과, CCα, CCß, 회수율, CV (%) 는 각각 0.12~0.74 ug/kg, 0.21~1.27 ug/kg, 90.96~104.80 %, 2.65~12.58 % 였다.
3. 결론
식품 내 존재하는 다양한 잔류동물용의약품을 분석하기 위해 가장 중요한 것은 적합한 분석법의 확립이다. 잔류동물용의약품 분석의 경우, 시료에 따라 추출효율, 방해물질의 종류 및 양이 매우 상이하여 식품군별에 따라 특화된 추출 및 정제법이 사용되는 경우가 많다. 그러므로 대상물질 계열 및 동일한 대상물질을 분석하더라도 시료에 따라 적합한 전처리 방법을 찾아 분석해야 한다(식약처, 2014). 그래서 대상 특성에 맞게 개별 분석법으로 확립된 경우가 많다. 그러나 개별분석법은 높은 정밀성과 신뢰성을 갖지만 그만큼 분석 결과를 얻기까지 시간이 오래 걸려서 스크리닝을 위한 방법으로 적합하지 않다. 스크리닝을 위한 분석법을 확립하기 위해 가장 중요한 것은 간결하고 효율적이며 적절한 LOD 를 확보하는 것이다. 그래서 전처리방법으로 QuEChERS 를 가장 많이 사용하고 있고, HPLC-MSMS 등 우수한 감도를 갖는 분석기기를 이용한 동시분석법이 많이 개발되고 있다. 그러나 대상물질들의 약리적 특성이 비슷하더라도 각각의 화학적 물성이 다르기 때문에 적합한 동시분석법을 확립하는 것은 쉽지 않으며 확립하기까지 장시간이 소요된다.
현재 국내에 고시된 식품 내 잔류동물용의약품 분석법은 동일 대상물질에 대해 개별분석법과 동시분석법이 혼재하고 있다. 분석기관들의 혼란을 방지하기 위해서도 단일 분석법의 확립과 스크리닝을 목적으로 하면서 분석대상 및 대상물질에 맞는 정밀성과 신뢰성을 확보한 분석법의 개선이 필요하다.
Acknowledgments
본 연구는 보건연구재단 (CMB)의 연구보조로 일부 수행되었습니다
References
-
Anastassiades, M., Maštovská, K., Lehotay, SJ., (2003), Evaluation of analyte protectants to improve gas chromatographic analysis of pesticides, Journal of Chromatography A, 1015, p163-184.
[https://doi.org/10.1016/S0021-9673(03)01208-1]

-
Barker, SA., Long, AR., Short, CR., (1989), Isolation of drug residues from tissues by solid phase dispersion, Journal of Chromatography A, 475(2), p353-361.
[https://doi.org/10.1016/S0021-9673(01)89689-8]

- CDC, (2014), CDC report, Antibiotic resistance in foodborne germs is an ongoing threat, http://www.cdc.gov/media/releases/2014Perez-Burgos /p0701-antibioticresistance.html.
-
Clarke, L., Fodey, TL., Crooks, SRH., Moloney, M., O'Mahony, J., Delahaut, P., O'Kennedy, R., Martin, Danaher, (2014), A review of coccidiostats and the analysis of their residues in meat and other food, Meat Science, 97, p358-374.
[https://doi.org/10.1016/j.meatsci.2014.01.004]

-
Dasenaki, ME., Thomaidis, NS., (2015), Multi-residue determination of 115 veterinary drugs and pharmaceutical residues in milk powder, butter, fish tissue and eggs using liquid chromatography–tandem mass spectrometry, Analytica Chimica Acta, 880, p103-121.
[https://doi.org/10.1016/j.aca.2015.04.013]

-
Donna, LD., Benabdelkamel, H., Taverna, D., Indelicato, S., Aiello, D., Napoli, A., Sindona, G., Mazzotti, F., (2015), Determination of ketosteroid hormones in meat by liquid chromatography tandem mass spectrometry and derivatization chemistry, Analytical and Bioanalytical Chemistry, 407(19), p5835-5842.
[https://doi.org/10.1007/s00216-015-8772-5]

-
Ehling, S., Reddy, TM., (2013), Liquid Chromatography–Mass Spectrometry Method for the Quantitative Determination of Residues of Selected Veterinary Hormones in Powdered Ingredients Derived from Bovine Milk, Journal of Agricultural and Food Chemistry, 61(48), p11782-11791.
[https://doi.org/10.1021/jf404229j]

-
Fan, YB., Yin, YM., Jiang, WB., Chen, YP., Yang, JW., Wu, J., Xie, MX., (2014), Simultaneous determination of ten steroid hormones in animal origin food by matrix solid-phase dispersion and liquid chromatography–electrospray tandem mass spectrometry, Food Chemistry, 142, p170-177.
[https://doi.org/10.1016/j.foodchem.2013.06.104]

-
Freitas, SKB., Paim, APS., Silva, PTSe., (2014), Development of a LC-IT-TOF MS Procedure to Quantify Veterinary Drug Residues in Milk Employing a QuEChERS Approach, Development of a LC-IT-TOF MS Procedure to Quantify Veterinary Drug Residues in Milk Employing a QuEChERS Approach, Food Analytical Methods, 7, p39-46.
[https://doi.org/10.1007/s12161-013-9595-7]

-
Furlani, RPZ., Dias, FFG., Nogueira, PM., Gomes, FML., Tfouni, SAV., Camargo, MCR., (2015), Occurrence of macrocyclic lactones in milk and yogurt from Brazilian market, Food Control, 48, p43-47.
[https://doi.org/10.1016/j.foodcont.2014.04.004]

-
Gaudin, V., Hedou, C., Soumet, C., Verdon, E., (2015), Evaluation and validation of a biochip multi-array technology for the screening of 14 sulphonamide and trimethoprim residues in honey according to the European guideline for the validation of screening methods for veterinary medicines, Food and Agricultural Immunology, 26(4), p477-495.
[https://doi.org/10.1080/09540105.2014.968767]

-
Iezzi, S., Lifschitz, A., Sallovitz, J., Nejamkin, P., Lloberas, M., Manazza, J., Lanusse, C., Imperiale, F., (2014), Closantel plasma and milk disposition in dairy goats: assessment of drug residues in cheese and ricotta, Journal of Veterinary Pharmacology and Therapeutics, 37(6), p589-594.
[https://doi.org/10.1111/jvp.12135]

-
Kang, J., Fan, CL., Chang, QY., Bu, MN., Zhao, ZY., Wang, W., Pang, GF., (2014), Simultaneous determination of multiclass veterinary drug residues in different muscle tissues by modified QuEChERS combined with HPLC-MS/MS, Analytical methods, 6, p6285-6293.
[https://doi.org/10.1039/C4AY00589A]

-
Kinsella, B., O’Mahony, J., Malone, E., Moloney, M., Cantwell, H., Furey, A., Danaher, M., (2009), Current trends in sample preparation for growth promoter and veterinary drug residue analysis, Journal of Chromatography A, 1216, p7977-8015.
[https://doi.org/10.1016/j.chroma.2009.09.005]

-
Lombardo-Agüí, M., García-Campa~na, AM., Cruces-Blanco, C., Gamiz-Gracia, L., (2015), Determination of quinolones in fish by ultra-high performance liquid chromatography with fluorescence detection using QuEChERS as sample treatment, Food Control, 50, p864-868.
[https://doi.org/10.1016/j.foodcont.2014.10.027]

-
Moloney, M., Clarke, L., O’Mahony, J., Gadaj, A., O’Kennedy, R., Danaher, M., (2012), Determination of 20 coccidiostats in egg and avian muscle tissue using ultra high performance liquid chromatography–tandem mass spectrometry, Journal of Chromatography A, 1253, p94-104.
[https://doi.org/10.1016/j.chroma.2012.07.001]

- Pe´ rez, MLG., Gonza´ lez, RR., Vidal, JLM., Frenich, AG., (2013), Analysis of veterinary drug residues in cheese by ultra-highperformance LC coupled to triple quadrupole MS/MS, Journal of Separation Science, 36, p1223-1230.
-
Pérez-Burgos, R., Grzelak, EM., Gokce, G., Saurina, J., Barbosa, J., Barrón, D., (2012), Quechers methodologies as an alternative to solid phase extraction (SPE) for the determination and characterization of residues of cephalosporins in beef muscle using LC–MS/MS, Journal of Chromatography B, 899, p57-65.
[https://doi.org/10.1016/j.jchromb.2012.05.002]

-
Schneider, MJ., Lehotay, SJ., Lightfield, AR., (2015), Validation of a streamlined multiclass, multiresidue method for determination of veterinary drug residues in bovine muscle by liquid chromatography–tandem mass spectrometry, Analytical and Bioanalytical Chemistry, 407, p4423-4435.
[https://doi.org/10.1007/s00216-014-8386-3]

-
Sun, H., Zuo, Y., Qi, H., Lv, Y., (2012), Accelerated solvent extraction combined with capillary electrophoresis as an improved methodology for simultaneous determination of residual fluoroquinolones and sulfonamides in aquatic products, Analytical Methods, 4, p670-675.
[https://doi.org/10.1039/c2ay05700j]

-
Wang, J., Leung, D., Chow, W., Chang, J., Wong, JW., (2015), Development and Validation of a Multiclass Method for Analysis of Veterinary Drug Residues in Milk Using Ultrahigh Performance Liquid Chromatography Electrospray Ionization Quadrupole Orbitrap Mass Spectrometry, Journal of Agricultural and Food Chemistry, 63, p9175-9187.
[https://doi.org/10.1021/acs.jafc.5b04096]

-
Wei, H., Tao, Y., Chen, D., Xie, S., Pan, Y., Liu, Z., Huang, L., Yuan, Z., (2015), Development and validation of a multi-residue screening method for veterinary drugs, their metabolites and pesticides in meat using liquid chromatography-tandem mass spectrometry, Food Additives & Contaminants: Part A, 32(5), p686-701.
[https://doi.org/10.1080/19440049.2015.1008588]

-
Yunin, MA., Metalnikov, PS., Komarov, AA., Panin, AN., (2015), Development of a rapid method for the analysis of trenbolone, nortestosterone, and zeranol in bovine liver using liquid chromatography tandem mass spectrometry, Analytical and Bioanalytical Chemistry, 407, p4363-4371.
[https://doi.org/10.1007/s00216-014-8346-y]

- 농림부, (2015), 농림축산식품 주요통계 2015 보고서, 농림축산식품부.
- 식약처, (2015), 식품공전, http://fse.foodnara.go.kr.
- 식약처, (2014), 잔류동물용 의약품분석법 실무 해설서, 식품의약안전처.